Autora : Alba María Cruz Hortelano
4º Curso Medicina grupo "A"
Código de trabajo : 2408-ACH ETIOLOGÍA DE LA ANEMIA DE LAS ENFERMEDADES CRÓNICAS
La anemia de las enfermedades crónicas o de los procesos crónicos (APC) forma parte de un trastorno inflamatorio crónico y es multifactorial. Fue establecida como entidad clínica en 1962. Generalmente la severidad de estas anemias es moderada y raramente son sintomáticas o requieren de terapia. La mayoría de las veces una infección crónica, una enfermedad autoinmunitaria (artritis reumatoide), una enfermedad renal, una insuficiencia cardíaca, o un cáncer; sin embargo, el mismo proceso parece comenzar de manera aguda durante casi cualquier infección o inflamación, incluso un traumatismo y una enfermedad crítica o después de una cirugía (1).
Los desórdenes clínicos comúnmente asociados con la APC se resumen a continuación (1):
-
Infecciones
crónicas
:
-
Pulmonares:
abscesos,
neumopatías
inflamatorias
crónicas,
tuberculosis, empiemas.
-
Endocarditis
bacteriana
subaguda.
-
Enfermedad
inflamatoria
pélvica.
-
Osteomielitis.
-
Infección
crónica
del
tracto
urinario.
-
Infecciones
micóticas
crónicas.
-
Meningoencefalitis
complicadas.
-
Infecciones
virales (VIH)
-
Enfermedades
malignas:
-
Carcinomas.
-
Enfermedad
de
Hodgkin.
-
Linfomas
no
Hodgkin.
-
Leucemias
crónicas.
-
Mieloma
múltiple.
La razón para asumir que las anemias observadas en un grupo de desórdenes clínicos crónicos están relacionadas, es que tienen ciertos rasgos comunes, como la existencia de una hiposideremia, que se expresa en niveles de hierro sérico y saturación de la transferrina disminuidos, en presencia de reservas tisulares o reticuloendoteliales de hierro aumentadas, reflejadas por niveles normales o elevados de ferritina sérica, acompañados de una velocidad de producción de eritrocitos reducida. La concentración de transferrina y los recuentos de reticulocitos son normales o algo reducidos, mientras que los niveles de receptor soluble de la transferrina están ligeramente aumentados.
En todo el mundo, la APC es la segunda en orden de frecuencia, por detrás de la anemia ferropénica. Al principio, los eritrocitos son normocíticos; con el tiempo, se tornan microcíticos, y existe un bajo recuento de reticulocitos. Los valores de hierro sérico y de transferrina sérica son típicamente bajos, mientras que el valor de la ferritina sérica puede ser normal o elevado. El problema principal es que la eritropoyesis está restringida debido a un secuestro inadecuado del hierro (1).
FISIOPATOLOGÍA
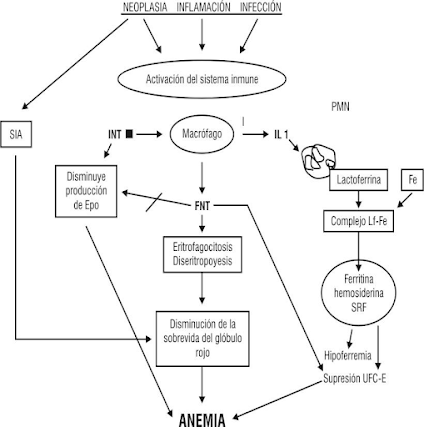
La fisiopatología de la APC implica una interacción intensa entre el tumor o proceso crónico y el sistema inmune; esta interacción conduce a la activación del macrófago y al incremento en la expresión de varias citocinas. Elevadas concentraciones de estas se han reportado en trastornos asociados con dicha entidad, y se consideran como factores potencialmente envueltos en la fisiopatología de la APC.
El incremento de citocinas inflamatorias como el interferón gamma (INF gamma), la interleucina 1 (IL-1) y el factor de necrosis tumoral (FNT), tienen un impacto negativo en la diferenciación de los precursores eritroides, en la producción de eritropoyetina (Epo) y contribuyen al defecto en la utilización del hierro.
El INF gamma estimula a los macrófagos a producir IL-1 y FNT, y entre los 3 son los responsables de la producción de la anemia por varias vías (1):
Ilustración 1. Fisiopatología de la anemia en los procesos crónicos.
SIA: sustancia inductora de la anemia; INF: interferón gamma; FNT: factor de necrosis tumoral; IL-1: interlucina 1; PNM: polimorfonuclear; UFC-E: unidades formadoras de colonias eritroides (1).
Se han identificado 3 mecanismos fisiopatológicos:
- La reducción de la vida media de los eritrocitos, que se considera secundaria al aumento actividad eritrofagocitaria (mecanismo extracorpuscular en el que influyen factores mecánicos y metabólicos que reducen la vida media eritrocitaria)
- Disminución de la eritropoyesis debido a la producción insuficiente de EPO (principal mecanismo en la insuficiencia renal crónica) y de la respuesta de la médula ósea a la EPO, hormonas tiroideas, andrógenos... Además, las citocinas inflamatorias pueden alterar la proliferación y la diferenciación eritroide a través de la formación de radicales y/o inducción de apoptosis.
- El metabolismo del hierro está alterado debido a un aumento de la hepcidina, que inhibe la absorción y el reciclado del hierro, lo que conduce a retención y bloqueo de hierro en el sistema reticuloendotelial. Esto impide su utilización por los precursores hematopoyéticos de la MO (principal mecanismo en la anemia por trastornos crónicos) (2).
Las células reticuloendoteliales conservan hierro de los eritrocitos envejecidos, por lo que no puede ser reutilizado para la síntesis de hemoglobina. Por lo tanto, no hay compensación de la anemia con mayor producción de eritrocitos. En pacientes con infecciones, estados inflamatorios o cáncer, las citocinas derivadas de macrófagos (IL-1- beta, IL-6, factor de necrosis tumoral-alfa, interferón-gamma) contribuyen a disminuir la producción de EPO y afectan la disponibilidad de hierro a través del aumento de la síntesis hepática de hepcidina.
Hepcidina. Principal responsable de la absorción intestinal de hierro y de su utilización por los macrófagos. Es un péptido pequeño sintetizado en el hígado, y en menor cantidad por los neutrófilos y macrófagos. Es liberado al plasma y se elimina por la orina.
Desempeña un papel fundamental en la homeostasis del hierro y está directamente vinculada con la inflamación y la inmunidad innata.
La secreción de hepcidina esta estimulada por la absorción de hierro y la liberación de citoquinas (IL-1, 1L-6) en situaciones de inflamación e infección. Su acción principal es inhibir el flujo celular de la proteína exportadora ferroportina y así retener el hierro en hepatocitos, enterocitos y macrófagos (3).
Ilustración 2. Mecanismo de acción de la hepcidina (3)
Click para aumentar tamaño.
DIAGNÓSTICO DE LA ANEMIA DE LA ENFERMEDAD CRÓNICA
- Investigar signos y síntomas del trastorno de base
- Hemograma completo
- Hierro sérico, ferritina, transferrina (y/o capacidad total de fijación de hierro)
- Recuento de reticulocitos
Por lo general, los hallazgos clínicos en la APC son los del trastorno de base (infección, inflamación, cáncer). Se sospecha APC en pacientes con anemia microcítica o normocítica que también tienen enfermedad crónica, infección, inflamación o cáncer. En caso de presunción de APC, se determina hierro sérico, transferrina, recuento de reticulocitos y ferritina sérica. Por lo general, la Hb es > 8 g/dL (> 80 g/L), a menos que otro mecanismo contribuya a la anemia como una deficiencia de hierro concomitante o flebotomía iatrogénica.
Un nivel de ferritina en suero < 100 ng/mL (< 224,7 pmol/L), en un paciente con inflamación (< 200 ng/mL [< 449,4 pmol/L] o en pacientes con enfermedad renal crónica) sugiere que hay deficiencia de hierro sobreagregada a la APC, porque la ferritina sérica suele estar elevada como un reactante de fase aguda.
Si el diagnóstico no es claro después de obtener los resultados de las pruebas de hierro tradicionales, la medición del receptor de transferrina soluble (sTFR) y el índice de sTFR- ferritina (elevado en la deficiencia de hierro) y/o el contenido de hemoglobina de los reticulocitos (ret-He), que es bajo en la deficiencia de hierro, puede ayudar a identificar una deficiencia concomitante de hierro y APC, aunque los resultados de estas pruebas también pueden estar sesgados por variables de confusión asociadas con la inflamación o por variables preanalíticas.
En pacientes con posible inflamación y en los que se han excluido otras causas de anemia, puede medirse la velocidad de sedimentación globular (VSG) y/o la proteína C reactiva (PCR) porque los resultados de estas pruebas son marcadores inespecíficos de inflamación (2).
DIAGNÓSTICO DIFERENCIAL
Los pacientes con infecciones, inflamaciones crónicas o enfermedades neoplásicas generalmente tienen anemia, que puede ser designada como APC, si la misma es moderada, con un patrón celular de la médula casi normal, el hierro sérico y la capacidad de unión de hierro son bajos, el contenido de hierro de los macrófagos medulares está normal o aumentado y la ferritina sérica está elevada (tabla 1).
Tabla 1. Características de la anemia de los procesos crónicos (APC) y de la deficiencia de hierro
Debido a que la enfermedad de base puede predisponer a los pacientes a muchas alteraciones hematológicas, el diagnóstico final de APC debe hacerse después de haber descartado otros mecanismos etiológicos.
Otras causas de anemia pueden combinarse con la APC y dificultar el diagnóstico, como son:
- Anemia dilucional.
- Supresión medular inducida por drogas o hemólisis producida por drogas.
- Pérdidas crónicas de sangre o malabsorción de hierro que pudiera eliminar la siderosis característica de los macrófagos, y que hay que apoyarse en el nivel de transferrina con vistas a distinguir entre la anemia por deficiencia de hierro y la APC.
- Fallo renal, que es causa tanto de un acortamiento de la vida media de los eritrocitos como de un fallo relativo de la médula.
- Remplazo metastásico de la médula por carcinoma o linfoma, que pueden agravar o enmascarar la APC.
El diagnóstico se confirma por la demostración de la hiposideremia con reservas reticuloendoteliales de hierro adecuadas en un paciente con un síndrome clínico propio. El principal diagnóstico diferencial es la anemia por deficiencia de hierro, y como hemos visto, esta no es una distinción sencilla.
Con frecuencia se marca incorrectamente a un paciente con APC como deficiente de hierro, con lo cual se expone a este paciente a procedimientos diagnósticos agresivos y costosos y a terapias inefectivas.
A diferencia de la ferritina sérica, el sTFR permanece normal en pacientes con inflamación aguda o crónica o con enfermedad hepática y parece ser efectivo para distinguir entre la anemia por deficiencia de hierro y la APC. Debe tenerse en cuenta que las determinaciones de receptor de transferrina por diferentes técnicas guían a resultados no comparables. Por lo tanto, la medición del sTFR no es utilizada rutinariamente en la práctica clínica, pues aún es cara, y solo debe usarse en pacientes en los que la cuantificación de células hipocrómicas no está disponible, o cuando la determinación de ferritina sérica, hierro sérico, transferrina y su saturación, no guían a una clasificación exacta del tipo de anemia (1).
TRATAMIENTO DE LA ANEMIA DE LOS PROCESOS CRÓNICOS
La mayoría de los pacientes presentan una anemia moderada asintomática. En el APC el grado de anemia refleja la actividad de la enfermedad y generalmente la anemia no es lo suficientemente severa para requerir tratamiento, sin embargo, alrededor del 20 al 30 % de los pacientes pueden requerir transfusiones de glóbulos. Objetivamente el tratamiento de esta anemia debe encaminarse al tratamiento y control de la enfermedad de base (4).
En algunos casos la anemia es más grave, empeorando la calidad de vida y el curso de la enfermedad que la ha producido. El objetivo terapéutico en todos los casos es alcanzar, al menos, Hb de 12 g/dl.
El suplemento de hierro puede ser útil con el objetivo de mantener la transferrina por encima del 20% y la ferritina >100 ng/ml. Sin embargo, en pacientes sin sospecha de deficiencia de hierro concomitante y en pacientes con infección aguda no controlada, generalmente se evita el suplemento de hierro.
La eritropoyetina humana recombinante o los agentes estimulantes de la eritropoyesis pueden considerarse en pacientes con enfermedad renal crónica o terminal, pacientes seleccionados con anemia inducida por quimioterapia y algunos pacientes antes de la cirugía electiva (2).
De forma general, la respuesta a la eritropoyetina recombinante (Epo) en ausencia de daño renal, es frecuentemente ineficaz. Sin embargo, algunos investigadores han reportado resultados satisfactorios en pacientes con artritis y cáncer, por lo que su uso requiere la individualización de cada caso.
La Epo actúa estimulando la actividad eritroide y puede ser particularmente beneficiosa en pacientes con cáncer, con respuesta anormal a la hipoxia tisular o post-quimioterapia inmunosupresora. Su utilidad es solo si los niveles de Epo sérica son inferiores a 500 mU/mL, y las dosis habitualmente recomendadas oscilan entre 100 y 300 U/Kg, administradas por vía subcutánea, 3 veces por semana. Los resultados se observan entre las semanas 4 y 8 de tratamiento.
La implicación de citocinas mediadoras de la respuesta inmune en la patogénesis de la APC sugiere que el tratamiento con anticitocinas pudiera ser beneficioso. Pacientes con artritis reumatoide han sido tratados con anti FNT y se ha informado reversión de la anemia; pero en la mayoría de las series estudiadas, no está claro si la mejoría de la anemia está en relación con la disminución de la actividad de la enfermedad o con uso de la anticitocina. No obstante, el uso de esta terapéutica es una posibilidad que debe ser cuidadosamente estudiada.
El tratamiento con hierro es controvertido; en general se considera poco o nada efectivo en la APC y su aplicación debe evitarse. Su indicación puede contribuir a empeorar la enfermedad de base, entre otras causas porque contribuye a la proliferación de las células neoplásicas y los microorganismos, y facilita la formación de radicales libres. Su uso solamente se justifica durante el tratamiento con Epo en los casos que la requieran, así como en los casos en que exista una deficiencia comprobada del micronutriente ajena a la enfermedad, lo que implica un cuidado riguroso y la evaluación periódica del estado hematológico y de hierro del paciente (1).
La transfusión de concentrados de hematíes se valorará según síntomas y comorbilidades. En los casos leves se intenta evitar (2).
BIBLIOGRAFÍA
1. Forrellat Barrios M, Fernández Delgado N. Anemia de los procesos crónicos: Aspectos clínicos y de laboratorio. Revista Cubana de Hematología, Inmunología y Hemoterapia. diciembre de 2002;18(3):0-0.


No hay comentarios:
Publicar un comentario
Se admiten comentarios que indiquen posibles errores en los textos y/o sugerencias de temas, y/o propuestas de mejoras en el blog y/o dudas sobre la realización de trabajos. Dado que este blog no es un consultorio médico, no se responderán preguntas realizadas con esa finalidad. Los comentarios que se consideren inapropiados, serán eliminados de inmediato, sin ningún tipo de excepción.
Nota: solo los miembros de este blog pueden publicar comentarios.