Autora : Arantza Toledo Espinilla
4º Curso de Medicina grupo "A" (curso 2024/25)
Código de trabajo : 2411-ATE
¿QUÉ ES EL FAVISMO?
El favismo se trata de una enfermedad metabólica y hereditaria, en la que los individuos tienden a desarrollar una hemólisis aguda provocada por el consumo de Vicia Faba (comúnmente conocidas como habas)(1).
A pesar de poder causar esta disfunción, Vicia Faba es una leguminosa que también tiene ciertos efectos positivos pues se ha visto que posee componentes beneficiosos para el organismo como son la L-DOPA molécula de gran interés para la cura del Parkinson u otros compuestos que han demostrado influir en la prevención de la arritmia cardiaca (2).
Otro efecto positivo es que se trata de una buena fuente proteica (30% de su composición nutricional). Además, presenta un bajo contenido en grasa y es fuente de proteínas del grupo B y de minerales como Fe, Ca y Zn (2).
Imagen 1. Planta de Vicia Faba de Carmen Goyoaga Jorba (3)
ORIGEN
Antiguamente ya se conocía que las habas producían ciertas enfermedades. De hecho, Pitágoras las prohibió comer diciendo que “el haba embota los sentidos y también infunde sueños” (4).
Las habas fueron de las primeras plantas cultivadas en Oriente Miedo, desde entonces se conocen sus efectos dañinos. Durante la Edad Media también se consumieron bastante debido a las hambrunas, y más tarde, con el descubrimiento de América, se sustituyeron por las alubias (3).
Los componentes de las habas que producen las alteraciones en la salud son según Ritthausen y Kreusler los compuestos glucosídicos pirimidínicos vicina y convicina. Más tarde fueron nombradas por Bendich y Clemens como beta-glucósidos pirimidínicos. Estos compuestos son muy ricos en la legumbre fresca e inmadura, ya que se forman en las primeras etapas del desarrollo. Sin embargo, cuando la legumbre es cocinada, pierde parte de estos componentes (3).
Hasta el siglo XX no se describió el cuadro clínico del favismo y fue en 1956 cuando Carson asoció la anomalía hemolítica a la deficiencia de una de las enzimas del ciclo de las pentosas fosfato, la glucosa-6-fosfato deshidrogenasa (G-6PDH). Más tarde se siguió investigando a fondo sobre esta enzima (5).
PREVALENCIA
El favismo es más frecuente en zonas del Mediterráneo, en oriente Medio, oriente lejano y el norte de áfrica, ya que en estas zonas hay un mayor consumo de habas. La prevalencia es mayor en hombres que en mujeres, esto se detallará mejor posteriormente cuando se hable de la prevalencia en personas con déficit de la G-6PDH, ya que es una enfermedad de herencia recesiva ligada al sexo. Además, se ha demostrado que los niños son más susceptibles a padecer la enfermedad que los adultos (6).
ETIOLOGÍA
La enfermedad se desencadena al ingerir la semilla comúnmente conocida como haba. Se han llegado a ver casos en neonatos que tomaron leche materna de madres que habían tomado habas (7).
Como se ha comentado anteriormente, el haba contiene beta-glucósidos que tienen mucha capacidad oxidante y exponen al eritrocito a un estrés oxidativo extremo. A parte del poder oxidativo, está claro que la persona que enferma debe tener una deficiencia en el funcionamiento de la enzima G-6PDH, que es protectora del hematíe en estado oxidativo. No obstante, hay más factores que provocan que la enfermedad se desarrolle o no como son el estado de la legumbre, la edad del individuo, la cantidad y la ingesta del haba en épocas de cosecha (7)(8).
LA ENZIMA GLUCOSA-6-FOSFATO-DESHIDROGENASA
La deficiencia de G-6PDH es la enzimopatía más frecuente. Se trata de una deshidrogenasa que participa en la primera reacción de la ruta metabólica de las pentosas fosfato, presente en distinto porcentaje en todas las células del ser humano. Su función es deshidrogenar la molécula de glucosa-6-fosfato generando como productos de esta reacción una molécula de 6-Fosfoglucono-delta-lactona y poder reductor en forma de NADPH + H+ (9).
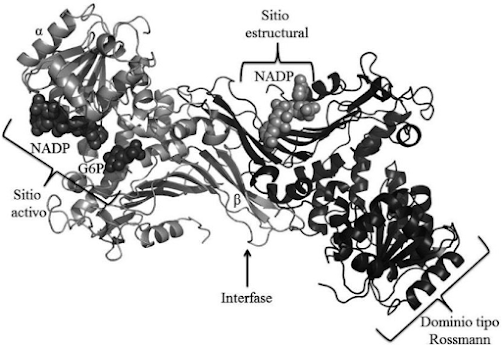
Imagen 3. Estructura de la glucosa-6-fosfato-deshidrogenasa.
Obtenida del artículo “Deficiencia de glucosa-6-fosfato deshidrogenasa: De lo clínico a lo bioquímico” por Jesús Oria-Hernández (10).
La deficiencia de la enzima G-6PDH se genera por una mutación en su secuencia de aminoácidos, esto no es algo raro porque es una enzima muy polimórfica. La mayoría de las mutaciones son por cambio de aminoácidos. El gen de la G-6PDH se encuentra insertado en la región telomérica del brazo largo del cromosoma X. Por tanto, es una enfermedad de herencia recesiva ligada al sexo (11).
El déficit de G-6PDH es la enzimopatía más común del mundo afectando a más de 400 millones de personas. Su prevalencia se ha definido en África, sureste asiático y central, zona mediterránea europea, Oriente medio. Además, se ha observado una extensión a zonas endémicas de malaria debido a que hay un carácter protector ante dicha enfermedad (12).
Imagen 4. Distribución de la prevalencia mundial
en la deficiencia G-6PDH según Nkhoma et al (13).
MANIFESTACIONES CLÍNICAS DEL DÉFICIT DE G-6PDH
Hay una amplia variedad de manifestaciones clínicas de la deficiencia de G- 6PDH pudiendo haber desde personas asintomáticas hasta anemias hemolíticas agudas. Además, hay una clara relación entre la gravedad clínica y el grado de deficiencia enzimática (8).
Según el tipo de mutación de la enzima se presentan varios cuadros clínicos de los que se han identificado 4 principales: anemia hemolítica congénita no esferocítica, favismo, anemia hemolítica aguda (inducida por infección o fármacos) e ictericia neonatal. Dentro de esto, los dos últimos suelen ser los más habituales (5).
En el caso concreto del favismo, las manifestaciones pueden ser: hemoglobinuria más grave que en otras formas clínicas, bilirrubina con valores menos elevados que en otras formas del déficit, anemia aguda y grave (que en ocasiones precipita fallo renal agudo por isquemia o depósitos de hemoglobina). Hay veces que podría desarrollarse esplenomegalia (7).
¿QUÉ LE OCURRE AL ERITROCITO SI HAY DÉFICIT DE G-6PDH?
La hemoglobina del eritrocito permanecerá oxidada y pierde su función al no poder unirse al oxígeno. Además, las moléculas de hemoglobina se irán aglutinando en la periferia de la célula dando lugar a los “corpúsculos de Heinz” típicos del favismo (14). Es difícil ver los corpúsculos de Heinz debido a que son rápidamente fagocitadas dando lugar a las “bite cells” (hematíes “mordidos) (15).
Imagen 5. Corpúsculos de Heinz (16).
Además, las proteínas de membrana también permanecen oxidadas lo que hará que el eritrocito presente un envejecimiento precoz. La forma cambiará dando lugar a glóbulos rojos hinchados, rugosas y con proyecciones espinosas (17).
Todo esto concluye en que el eritrocito termine exponiendo en la membrana la moléculas, que indican al sistema reticuloendotelial que debe ser retirado de la circulación o que se produzca la lisis de la célula liberando las moléculas oxidantes a la sangre (15).
CLÍNICA DEL FAVISMO
La manifestación clínica característica del favismo es la hemólisis aguda, que aparece al día o a los dos días de la ingesta y que puede cursar como una anemia aguda. Lo más frecuente es que sea leve y acabe en unas horas. Además de la hemolisis, se han observado otros síntomas como los siguientes (8) :
- El primer día puede aparecer debilidad, letargo, palidez, náuseas y vómitos, dolor de cabeza, dolor lumbar o abdominal y fiebre
- El segundo día hay signos clínicos de destrucción de hematíes: hiperbilirrubinemia indirecta que da lugar a ictericia, hemoglobinuria por la liberación de hemoglobina al torrente, metahemoglobina en sangre y en los casos más graves un estado de insuficiencia renal por depósito de hemoglobina (7).
- Es posible que se desarrolle esplenomegalia a largo plazo.
DIAGNÓSTICO
Para diagnosticar el favismo es necesario medir la actividad de la encima G- 6PDH en los eritrocitos y no está indicado hacer la prueba tras un episodio hemolítico agudo, ya que los eritrocitos afectados no se mostrarán al haber caído y se podrá obtener un falso negativo (8).
Como el favismo esta directamente relacionado su manejo estará determinado por el control de la enzima G-6PDH.
TRATAMIENTO
Lo primero de todo es conocer a los pacientes que presentan déficit de G-6PDH. Una vez localizados, lo ideal sería prevenir la hemólisis.
La Sociedad Española de Hematología y Hemoterapia (SEHH) afirma que los pacientes deben ser conocedores saber que la estrategia más eficaz en el manejo de esta entidad es la prevención de la hemólisis (18). Para ello, se le deberá explicar al paciente los riesgos de presentar el déficit de la enzima y los factores que pueden desencadenar la hemólisis. Los pacientes deben estar informados de cómo evitar los factores asociados al estrés oxidativo como por ejemplo la ingesta de habas (19). Además, deben evitar una serie de medicamentos y en caso de necesitar de analgesia, se recomienda el uso de paracetamol (7).
Normalmente el paciente ya ha sufrido alguna crisis antes, asi que es probable que conozca muchos de los factores desencadenantes. Habrá que explicarle que la sintomatología dependerá de la intensidad de la anemia y la velocidad de su instauración. Habrá que hacer por tanto un manejo enfocándose en las anemias hemolíticas (7).
Es importante hacer una buena historia clínica en la que se incluyan (7) :
Antecedentes personales:
- Edad, sexo y etnia: ya que el déficit de la enzima esta asociada a varones al estar ligado al cromosoma. También es más prevalente en poblaciones de raza negra y zona endémicas de malaria.
- Evolución de los síntomas: así se conocerá si el cuadro es agudo o crónico.
- Episodios similares previos.
- Síntomas infecciosos que van asociados incluso en días previos pudiendo ser desencadenantes.
- Fármacos habituales.
- Ingesta de habas.
- Aspecto de la orina.
Antecedentes familiares:
- Historia familiar de anemia e ictericia.
- Historia familiar de litiasis biliar.
- Historia familiar de esplenectomía (anemias hemolíticas hereditarias).
- Casos de episodios similares en la familia.
Exploración física: Estará encaminada a ver las manifestaciones clínicas de las crisis hemolíticas agudas, al ser éstas las más frecuentes. Se valorará la coloración de la piel y las mucosas (palidez, ictericia); la frecuencia cardiaca y presión arterial (taquicardia, hipotensión); auscultación cardiopulmonar (soplos); datos clínicos de fallo cardiaco (edemas, hepatomegalia, hipotensión arterial, dificultad respiratoria); hepato/esplenomegalia. Las formas crónicas son menos sintomáticas.
Exploraciones complementarias: si hay una crisis hemolítica aguda, el paciente deberá ser enviado a un hospital para ser estudiado y tratado. Se solicitarán las siguientes pruebas (7) :
- Hemograma + reticulocitos + pruebas cruzadas + Coombs directo.
- Frotis en sangre periférica.
- Bioquímica de sangre. En el que se podrá contemplar elevación de LDH, bilirrubina tanto total como fraccionada y GOT; datos de insuficiencia renal por el daño que hacen los metabolitos de la hemoglobina; haptoglobina baja (<30 mg/dl).
- Orina: Hemoglobinuria, urobilinógeno.
- Si hay clínica infecciosa se pedirán: Serologías infecciosas y cultivos.
- Si hay déficit de la enzima G6PDH hay que realizar un estudio enzimático específico para determinar la actividad enzimática. Sin embargo, no se suele caracterizar la enzima completa.(5)
TRATAMIENTO DE LAS CRISIS HEMOLÍTICAS AGUDAS
Las medidas descritas están indicadas en el caso de déficit de la G-6PDH (7).
Medidas generales (7) :
- Habrá que ingresar al paciente para que el control sea más estrecho. En el caso de no poder controlar al paciente pueden valorarse cuidados intensivos pudiendo ser necesarias las trasfusiones sanguíneas frecuentes.
- Las trasfusiones de concentrados de hematíes están indicadas siempre que exista alteración hemodinámica y si las cifras de hemoglobina están por debajo de 7g/dl. En el caso de que la hemoglobina esté entre 7 y 9 g/dl habrá que valorar al paciente y si persisten datos que indican hemólisis intravascular activa (hemoglobinuria) se transfundirá el concentrado de hematíes. Por el contrario, si no hay datos de hemólisis intravascular activa, habrá que observar al paciente con controles clínicos y analíticos muy frecuentes (cada 9-24 horas).
- Retirar el agente externo desencadenante. Estos podrían ser tanto fármacos como las habas.
- Si hubiese sintomatología infecciosa bacteriana habrá que emplear un tratamiento antibiótico específico.
- Si la hemólisis es intravascular habrá que hidratar al paciente y alcalinizar su orina. Esto se hará así:
- Suero glucosado al 5%: necesidades basales + 50%. No añadir potasio.
- Bicarbonato sódico 1 M: 30-40 mEq/L (para mantener pH urinario entre 7-8) como medida de protección renal.
- Ácido fólico: un comprimido de 5 mg/día mientras dure la crisis hemolítica.
- En los casos agudos habrá que hacer un control clínico-analítico estrecho controlando la anemia y la respuesta medular. Para ello, se hará un hemograma con bioquímica con LDH cada 6-8-12-24 horas y reticulocitos cada 24-48 horas, control de la hemoglobinuria con tira de orina en cada micción, así como control clínico exhaustivo con constantes por turno de enfermería.
En el caso del favismo, los pacientes no presentan dependencia transfusional y no hay que establecer un seguimiento concreto. En los casos de déficit de la enzima G6PDH con curso crónico debe seguirse un control periódico, ya que hay un riesgo importante de crisis hemolítica (7).
En lo referido a la alimentación, los pacientes con favismo pueden seguir una alimentación completamente normal, exceptuando la ingesta de habas o productos que las contengan, como purés o potajes, que quedan prohibidos. También se recomienda evitar el contacto con la planta del haba (7).
Además, los pacientes con déficit del enzima deben visitar a su médico si presentan cuadros infecciosos con el objetivo de valorar el inicio de una crisis hemolítica (7).
Los pacientes que presentan enfermedades crónicas como por ejemplo la diabetes, tienen que ser vigilados de cerca (7).
La Dra. Frank, en su publicación en American Family Physician (20), comenta que hay que hacer un cribado neonatal de déficit de G-6PDH si hubiera ictericia neonatal cuando hay antecedentes familiares de este déficit y según la procedencia geográfica y étnica.
Por último, destacar que el déficit de G-6PDH no suele afectar a la calidad y la esperanza de vida de los pacientes pudiendo llevar una vida normal. Por suerte, muchos de los afectados con esta alteración están asintomáticos la mayor parte del tiempo (5).
BIBLIOGRAFÍA
1.- Osman HG, Zahran FM, El-Sokkary AMA, Sabry AM. Oxidative stress and antioxidant defense in Egyptian favism patients. Eur Rev Med Pharmacol Sci. mayo de 2013;17(9):1211-7.
2.- Scribd [Internet]. [citado 25 de octubre de 2024]. Estudio de Factores No Nutritivod en Vicia Faba Influencia de La Germinación | PDF | Legumbre | Carbohidratos. Disponible en: https://es.scribd.com/document/111323615/estudio-de-factores-no- nutritivod-en-vicia-faba-influencia-de-la-germinacion
3.- Diez de Fuentes, S. Favismo : Deficiencia de glucosa–6–fosfato deshiudrogenasa. Trabajo fin de grado curso 2015/16. Facultad de Medicina. Universidad de Valladolid.
Disponible en internet : TFG-M-N519.pdf.
4.- Munguía SS, Ripa JT. Historia de las plantas en el mundo antiguo. Editorial CSIC - CSIC Press; 2009. 480 p.
5.- Cappellini MD, Fiorelli G. Glucose-6-phosphate dehydrogenase deficiency. Lancet. 5 de enero de 2008;371(9606):64-74.
6.- Zuccotti GV, Redaelli F, Gualdi V, Rizzi V, Mameli C, Dilillo D, et al. Hemolytic crisis in a G6PD-deficient infant after ingestion of pumpkin. Italian Journal of Pediatrics. 21 de julio de 2014;40:71.
7.- Bello Gutiérrez P, Mohamed Dafa L. Déficit de glucosa-6-fosfato deshidrogenasa: revisión a propósito de un caso. Pediatría Atención Primaria. diciembre de 2015;17(68):361-8.
8.- Verdugo L P, Calvanese T M, Rodríguez V D, Cárcamo C C. Deficiencia de glucosa 6 fosfato deshidrogenasa en niños: Caso clínico. Revista chilena de pediatría. febrero de 2014;85(1):74-9.
9.- Dorgalaleh A, Shahzad MS, Younesi MR, Moghaddam ES, Mahmoodi M, Varmaghani B, et al. Evaluation of liver and kidney function in favism patients. Med J Islam Repub Iran. febrero de 2013;27(1):17-22.
10.- Estructura tridimensional del dímero de G6PD humana. Se indican los... | Download Scientific Diagram [Internet]. [citado 25 de octubre de 2024]. Disponible en: https://www.researchgate.net/figure/Figura-4-Estructura-tridimensional-del-dimero-de-G6PD-humana-Se-indican-los- principales_fig4_271507459
11.- Beutler E, Yeh M, Fairbanks VF. The normal human female as a mosaic of X-chromosome activity: studies using the gene for C-6-PD-deficiency as a marker. Proc Natl Acad Sci U S A. 15 de enero de 1962;48(1):9-16.
12.- Osman HG, Zahran FM, El-Sokkary AMA, Sabry AM. Oxidative stress and antioxidant defense in Egyptian favism patients. Eur Rev Med Pharmacol Sci. mayo de 2013;17(9):1211-7.
13.- Nkhoma ET, Poole C, Vannappagari V, Hall SA, Beutler E. The global prevalence of glucose-6-phosphate dehydrogenase deficiency: a systematic review and meta-analysis. Blood Cells Mol Dis. 2009;42(3):267-78.
14.- Aguilar-da-Silva RH, Moraes TP, Moraes G. Implicações do estresse oxidativo sobre o metabolismo eritrocitário de pessoas com Síndrome de Down. Rev Bras Hematol Hemoter. 2003;25:231-7.
15.- Fang Z, Jiang C, Tang J, He M, Lin X, Chen X, et al. A comprehensive analysis of membrane and morphology of erythrocytes from patients with glucose-6-phosphate dehydrogenase deficiency. J Struct Biol. junio de 2016;194(3):235-43.
16.- User S. Cuerpos de Heinz [Internet]. [citado 25 de octubre de 2024]. Disponible en:
https://atlas.gechem.org/index.php?option=com_k2&view=item&id=224:cuerpos-de-heinz&lang=es
17.- Baker MA, Bosia A, Pescarmona G, Turrini F, Arese P. Mechanism of action of divicine in a cell-free system and in glucose-6-phosphate dehydrogenase- deficient red cells. Toxicol Pathol. 1984;12(4):331-6.
18.- SEHH - Sociedad Española de Hematología y Hemoterapia [Internet]. [citado 27 de octubre de 2024]. Disponible en: https://www.sehh.es/
19.- Grupo Español de Eritropatologia [Internet]. [citado 27 de octubre de 2024]. Disponible en: https://eritropatologia.com/
20.- Frank JE. Diagnosis and management of G6PD deficiency. Am Fam Physician. 1 de octubre de 2005;72(7):1277-82.




No hay comentarios:
Publicar un comentario
Se admiten comentarios que indiquen posibles errores en los textos y/o sugerencias de temas, y/o propuestas de mejoras en el blog y/o dudas sobre la realización de trabajos. Dado que este blog no es un consultorio médico, no se responderán preguntas realizadas con esa finalidad. Los comentarios que se consideren inapropiados, serán eliminados de inmediato, sin ningún tipo de excepción.