Autora : Cristina García-Casarrubios Villafranca
4º Curso Medicina Grupo "B" (curso 2022/23)
Código de trabajo : 2208-CGV
INTRODUCCIÓN
La insuficiencia renal crónica es una enfermedad que se adquiere a lo largo de un tiempo variable que consiste en la pérdida progresiva de la tasa de filtrado glomerular, siendo la tasa de aclaramiento de creatinina <60ml / min / 1,73m2 (1). También se define como la pérdida progresiva en el número de nefronas que provoca un daño renal persistente durante al menos 3 meses con las consiguientes incapacidades a nivel del riñón: depurativa, excretoras, reguladores y endocrino – metabólicas (2).
En lo que a la hematología respecta, en el riñón, concretamente en las células yuxtatubulares, es donde tiene lugar la síntesis de la eritropoyetina, la cual es una hormona glucoporoteica que regula la producción y diferenciación eritrocítica. Su síntesis está regulada por la disponibilidad de oxígeno, de forma que cuanto menor sea la concentración de oxígeno en la sangre, mayor será su síntesis. Esta enzima se una a las células madre hematopoyéticas CD34+, de forma que se produce una activación de genes que estimulan la proliferación y diferenciación hasta eritrocitos maduros (3).
Teniendo los conceptos previos claros, ante un cuadro de insuficiencia renal crónica se produce una deprivación de la síntesis de eritropoyetina y, una de las complicaciones secundarias a esta patología es la anemia normocítica normocrómica de la que hablaremos a lo largo del trabajo (4).
EPIDEMIOLOGÍA
De acuerdo con un estudio epidemiológico llevado a cabo en Cataluña en 2013 en pacientes con insuficiencia renal crónica en estadios 3-5, no en tratamiento con diálisis, en el cual participaron 504 pacientes (56,4% varones, 44,6% mujeres y la edad media 67,8%), el 58,5% padecía anemia, no obstante, solo un 14,9% tenían niveles de hemoglobina <11g/dl. Cabe mencionar que fue considerado anemia niveles de hemoglobina <13g/dl en el caso de varones y <12g/dl en las mujeres (5).
En base a los datos de la Encuesta Nacional de Examen de Salud y Nutrición (NHANES) en Colombia en 2021, la anemia resultó dos veces más prevalente en personas con ERC (15,4%) que en la población general (7,6%). La prevalencia de la anemia aumenta con el estadio de la ERC, de forma que un 8,4% tenía anemia en el estadio 1 frente al 53,4% en el estadio 5 (6).
Por último, una encuesta multinacional realizada en 2010 a 9025 pacientes en 16 países de Latinoamérica que recopiló datos sobre el manejo de la anemia de pacientes adultos en tratamiento con hemodiálisis, se identificó que solo el 32,7% de los pacientes estaban dentro del objetivo de Hb de 10,5-12,0 g/dL, frente al 46,3% que estaba por debajo y el 21,1% por encima (6).
ETIOLOGÍA
A la hora de desarrollar anemia, primero tenemos que conocer las causas por las que se produce la insuficiencia renal crónica. La mayoría de las enfermedades renales progresivas acaban mostrando una histología final común donde el riñón se muestra como una masa fibrótica reducida de tamaño; los glomérulos pierden los capilares y muestran áreas de cicatrización que puede provocar el colapso del lecho capilar. Se produce también una disminución en el número de glomérulos, así como una obliteración de las estructuras tubulares (7).
Las principales causas en el desarrollo de insuficiencia renal crónica son: HTA mal controlada, microalbuminuria, mal control de la diabetes, dislipemia, enfermedades cardiovasculares, anemia, edad >70 años y sexo masculino. También existen factores que aumentan el riesgo de desarrollarla, como presentar historia familiar de enfermedad, raza no caucásica, así como bajo peso al nacer. Se debe tener también en cuenta que existen fármacos que son nefrotóxicos: AAS, paracetamol, AINEs, Litio, etc (7).
Como se ha mencionado anteriormente, en las células yuxtatubulares es donde se produce la síntesis de eritropoyetina en respuesta a la hipoxia local, de forma que el daño por fibrosis o isquemia de estas células provoca una disminución en la síntesis de EPO, siendo esta la principal causa de anemia. La disminución de la síntesis de EPO también se produce por la presencia de toxinas urémicas que inhiben la síntesis de EPO. La causa secundaria de anemia más importante en pacientes con diálisis por insuficiencia renal crónica es el déficit de hierro que se produce por el aumento de las pérdidas de sangre debidas a sangrado gastrointestinal o por pérdidas en el dializador. La hormona paratiroidea también está involucrada en el desarrollo de anemia al contribuir a la osteítis fibrosa, complicación que disminuye la respuesta al efecto de la EPO. La anemia también podría producirse como consecuencia de una mala alimentación del enfermo, por pérdidas hemorrágicas o por una mala utilización del hierro como consecuencia de un proceso inflamatorio crónico (8,9).
Ilustración 1: Cuadro resumen que explica el proceso normal de síntesis de Eritropoyetina, la cual, se sintetiza en el riñón. Su síntesis se produce ante situaciones de hipoxia, de forma que la EPO actúa a nivel de la médula ósea uniéndose a progenitores eritroides. Imagen extraída de https://www.biolaster.com/hipoxia/rendimiento- fisico/eritropoyetina-epo/epo_regulacion.jpg
FISIOPATOLOGÍA
Producción inadecuada
En condiciones normales, en la médula externa de la nefrona existe un ambiente carente de oxígeno, de forma que se activan factores inducibles por hipoxia (HIF) que conducen a una mayor transcripción de genes, que a su vez conducen a la síntesis de EPO. La EPO se une al receptor EPO expresado en las células progenitoras eritroides, inhibiendo la apoptosis y, por tanto, mejorando la población de glóbulos rojos en sangre. Sin embargo, una disminución de la función renal provoca que el funcionamiento de este proceso no sea el óptimo, produciéndose así una disminución en la síntesis de glóbulos rojos y, como consecuencia, anemia. Esta manifestación clínica se produce generalmente cuando la tasa de filtración glomerular es <30ml/min/1,73m2 (10).
Deficiencia de hierro
Los pacientes con insuficiencia renal crónica son propensos a la deficiencia absoluta de hierro, teniendo un papel muy importante la hepcidina, no obstante, se produce una combinación de diversos procesos (10):
La uremia puede provocar anorexia, de forma que se tiene a una disminución de la ingesta de alimentos y, como consecuencia, a una disminución de la ingesta de hierro.
Otro de los procesos implicados es la inflamación crónica que se produce en la insuficiencia renal crónica; se produce un aumento de las citoquinas inflamatorias que inducen al hígado a la liberación de hepcidina, la cual inhibe la absorción de hierro por los enterocitos y, al no poder excretarse por su vía habitual (vía renal), sus concentraciones se ven aumentadas y, con ello, disminuye considerablemente la absorción de hierro.
Por último, es muy común en los pacientes con IRC la presencia de sangrado gastrointestinal como consecuencia de la combinación de lesiones gastrointestinales como la angiodisplasia de la mucosa y la disfunción plaquetaria urémica.
Respuesta inadecuada de la médula ósea a la EPO
Las citoquinas inflamatorias afectan a la capacidad de respuesta de la médula ósea a la EPO (10).
Supervivencia acortada de los glóbulos rojos
Este proceso se ha reconocido durante mucho tiempo aunque escaseen los estudios acerca de ello (10).
Hiperparatiroidismo secundario
El hiperparatiroidismo secundario es una afectación que aparece en fases avanzadas de la enfermedad y, provoca una resistencia a los agentes estimulantes de la eritropoyesis. Los mecanismos son poco conocidos aunque se sabe que la hormona paratiroidea provoca una síntesis reducida de EPO y una inhibición de los progenitores eritroides, además de la inducción de la fibrosis de la médula ósea (10).
Déficit de vitamina B12 y ácido fólico
En la insuficiencia renal crónica es común encontrar deficiencias o alteraciones en el metabolismo de las vitaminas debido a las toxinas urémicas, restricciones dietéticas, procesos catabólicos, pérdidas durante el tratamiento de diálisis e interacciones farmacológicas. Tales déficits originan una anemia macrocítica (6).
CLÍNICA
La anemia asociada a la IRC es habitualmente normocítica, normocrómica y sin ferropenia (ferritina >100ng/mL e índice de saturación de transferrina >20%), no obstante, como se ha mencionado anteriormente, puede haber diferentes causas que provoquen ferropenia en el contexto de insuficiencia renal crónica.
La anemia crónica puede afectar negativamente a la función cardiaca, provocando vasodilatación, dilatación ventricular, así como un aumento del gasto cardíaco, lo que puede dar lugar a una hipertrofia del ventrículo izquierdo como mecanismo de compensación. Otras manifestaciones clínicas son: fatiga, cansancio, dificultad respiratoria, piel pálida, dolor en el pecho, mareo, taquicardia, dolor de cabeza, etc (1).
TRATAMIENTO
Antes de iniciar el tratamiento con EPO se deben evaluar los niveles de hierro del paciente, teniendo en cuenta el nivel sérico de ferritina, la saturación de transferrina, así como la concentración de hemoglobina en los hematíes (9). Se recomienda administrar hierro a la mayoría de pacientes con insuficiencia renal crónica que tienen una tasa de saturación de transferrina ≤20% y una concentración de ferritina sérica ≤100 ng/ml (6). Una vez medidos tales parámetros, si existe un déficit de hierro se deberá proceder a la corrección de este. Se sabe que un mes de tratamiento previo con hierro suele ser suficiente para que la EPO sea eficaz (9).
El tratamiento con hierro debe ser suplementos de hierro oral, administrado en forma de fumarato, sulfato o gluconato ferroso, siendo la dosis de 100-150mg/día. Al existir interferencia con los alimentos para su absorción, se debe administrar éste dos horas después de las comidas. En el caso de pacientes en hemodiálisis con niveles séricos de ferritina menor de 100mg/L y en tratamiento con EPO, a veces no absorben suficiente hierro oral, por lo que debería considerarse el tratamiento con hierro parenteral. 9
En el caso del tratamiento con eritropoyetina, como se ha mencionado, se debe corregir antes el déficit de hierro y controlar la tensión arterial. Se recomienda administrar AEE a la mayoría de los pacientes con IRC que tienen una hemoglobina (Hb) <10 g/dL, siempre que la saturación de transferrina (TSAT) sea> 25 por ciento y ferritina> 200 ng/ml. A los pacientes con TSAT ≤ 25 por ciento y ferritina ≤ 500 ng/ml, generalmente se administra hierro antes de administrar un AEE, ya que pueden responder al hierro con un aumento de Hb. La EPO se puede administrar por vía intravenosa, intramuscular e intraperitoneal, no obstante, la subcutánea es la más eficaz, siendo la dosis de inicio de 25 U/Kg tres veces a la semana (6, 9).
Los agentes estimulantes de la eritropoyesis que hay disponibles en la actualidad son la eitropoyetina alfa, beta y darbepoyetina alfa, las cuales se diferencian en sus modificaciones farmacológicas, afinidades de unión al receptor de EPO y vida media (8).
Se ha descubierto que el tratamiento de estimulación de la eritropoyesis, los niveles de hemoglobina fluctúan por encima o por debajo de los niveles en periodos cortos de tiempo. De esta forma se producen estallidos cortos, intermitentes y no biológicos de disponibilidad de eritropoyetina plasmática, dando como resultado un aumento y una disminución de la hemoglobina en el paciente. Como consecuencia, los pacientes pueden correr el riesgo de una mayor hospitalización y mortalidad, porque los niveles de hemoglobina tanto bajos como altos se asocian con un aumento de los eventos cardiovasculares y la muerte (6).
En cuanto a los beneficios de la utilización de EPO destacamos (9) :
- Disminución en el número de transfusiones.
- Mejoría de la función sexual debido al aumento de la testosterona en el varón y LH y estradiol en la mujer.
- Aumento del apetito y menor cansancio.
- Puede producirse regresión de la hipertrofia del ventrículo izquierdo una vez la tensión arterial esté controlada.
Por otro lado, el tratamiento con EPO puede dar lugar a diferentes efectos secundarios (9):
Hipertensión: diferentes estudios han revelado que la EPO presenta un efecto vasoconstrictor a través de su acción directa sobre la endotelina que se encuentra en las paredes de los vasos. Otra posible causa de la hipertensión es el aumento de la viscosidad de la sangre debido a un aumento del hematocrito. De esta forma, se recomienda un control adecuado de la tensión arterial.
Fenómenos trombóticos: como se ha comentado anteriormente, se ha comprobado un aumento de los fenómenos trombóticos como consecuencia del aumento del hematocrito así como el aumento de la agregación plaquetaria y la disminución de las proteínas C y S.
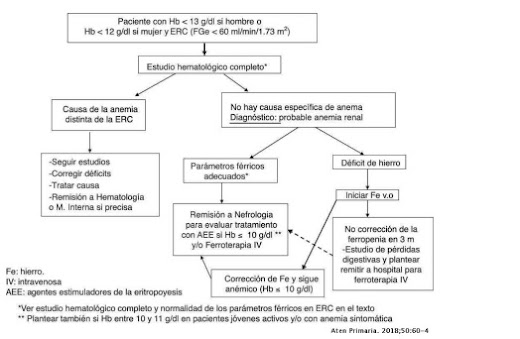
Ilustración 2: esquema sobre el manejo del paciente con anemia en insuficiencia renal crónica. Se debe llevar a cabo un estudio hematológico completo, primero valorando si la causa de la anemia no es renal. Habiendo descartado esto, se supondrá que la posible causa de la anemia sea debido a la enfermedad renal. Primero debemos valorar los niveles de hierro y, si estos fueran adecuados, se procederá a una remisión del paciente al servicio de Nefrología para pautar el tratamiento adecuado con agentes estimulantes de eritropoyesis. En el caso de que hubiera alguna alteración a nivel del hierro, se deberá corregir este primero.
Imagen extraída de
https://multimedia.elsevier.es/PublicationsMultimediaV1/item/multimedia/S0212656717306649:gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w997EogCnBdOOD93cPFbanNeiCVkJWzXJsOk1sisXufhEduh2ytEfB75Uwcvu2Bf/vopEWwDTbOZiBerDItn9AaQMTRuoa1GHf/hKGZgC/j3i0U2WFG5pkyQCgKOn4vbXm89Ja6RUyBPhSc+mjZIYcUY2PiLDTGeysk/Ya4yykbufyb4q/Gabo8Rhpb8Ro732+QZ8mPVRIZtJYjl6hcXV2aCSjmcXV5D+ Iwax9u7i5KXsWuJiM9VBQc4N/2glksnoWzKphTe5m2fxJiXjiUIlpTU=
BIBLIOGRAFÍA
1.- Andrés, E., Servicio, R., Fundació, N., & Barcelona, P. (2004). Fisiopatología de la insuficiencia renal crónica. Pbworks.com.
http://clinicalevidence.pbworks.com/w/file/fetch/28241671/FISIOPATO%20RENAL%20CRONICA.pdf
2.- Int, R. n. (s/f). INSUFICIENCIA RENAL CRÓNICA. Segg.es. Recuperado el 30 de marzo de 2023, de https://www.segg.es/tratadogeriatria/PDF/S35- 05%2062_III.pdf
3.- De los Ríos-Morales, L. A., Guevara-Arismendy, N. M., Vizcaíno-Carruyo, J. C., & Toro-Montoya, A. I. (2020). Eritropoyetina (EPO). Medicina y Laboratorio, 24(4), 344–347. https://doi.org/10.36384/01232576.342
4.- Cases, A., Egocheaga, M. I., Tranche, S., Pallarés, V., Ojeda, R., Górriz, J. L., & Portolés, J. M. (2018). Anemia en la enfermedad renal crónica: protocolo de estudio, manejo y derivación a Nefrología. Atencion primaria, 50(1), 60–64. https://doi.org/10.1016/j.aprim.2017.09.007
5- Cases-Amenós, A., Martinez-Castelao, A., Fort-Ros, J., Bonal-Bastons, J., Ruiz, M. P., Vallés-Prats, M., Coll-Piera, E., Galcerán-Gui, J. M., & Investigadores del Estudio Micenas I. (2014). Prevalence of anaemia and its clinical management in patients with stages 3-5 chronic kidney disease not on dialysis in Catalonia: MICENAS I study. Nefrologia: Publicacion Oficial de La Sociedad Espanola Nefrologia, 34(2), 189–198.
https://doi.org/10.3265/Nefrologia.pre2013.Dec.12261
6.- Pertuz, A., García, C. I., Gómez, C. M., Fontalvo, J. E. R., Arnedo, R. D., Pájaro, N., Daza, J. A. C., Calvo, C. P., Gulfo, I. U., Serpa, Ó. V., & Miranda, A. P. (2021). Anemia en enfermedad renal cronica. Archivos de medicina, 17(2), 1. https://dialnet.unirioja.es/servlet/articulo?codigo=7848785
7.- Apuntes Nefrología de la Asignatura de Semiología del Dr. Broseta
8.- Social, S. (s/f). Revista Médica del Instituto Mexicano del. Redalyc.org. Recuperado el 30 de marzo de 2023, de https://www.redalyc.org/pdf/4577/457745499011.pdf
9.- Soriano, D. S. (s/f). Anemia en insuficiencia renal crónica. Revistaseden.org. Recuperado el 30 de marzo de 2023, de https://www.revistaseden.org/files/art555_1.pdf
10.- Fisiopatología de la anemia renal. (s/f). Nefro.cl. Recuperado el 30 de marzo de 2023, de https://www.nefro.cl/web2/old/articulo.php?id=657