Autor: Ángel José Vadillo López.
4º Curso de Medicina Grupo B (curso 2022/2023)
Código de trabajo : 2207-AVL
INTRODUCCIÓN
La micosis fungoide (o Síndrome de Alibert-Bazines) es un trastorno progresivo crónico y no contagioso de la piel que forma parte de los linfomas no hodgkinianos. Su nombre, que significa ‘enfermedad fúngica parecida a hongos’ se acuñó por la similitud de la apariencia de las lesiones con las de una enfermedad producida por hongos. Se caracteriza por la proliferación de células T a nivel cutáneo, siendo la expresión más frecuente de linfoma cutáneo de células T. Se presenta con afectación de la piel en forma de brotes. Está muy relacionada con el Síndrome de Sézary, la cual es una forma más agresiva de la misma enfermedad con afectación extracutánea (1).
La micosis fungoide fue descrita por primera vez en 1806 por el dermatólogo francés Jean-Louis- Marc Alibert, al atender a un paciente de 56 años con tumores en la piel de apariencia fúngica, describiendo sus lesiones como “un proceso descamativo de la piel y poco después le aparecen tumores por distintas zonas del cuerpo. Se parecen a hongos, de consistencia como setas”. En 1870 Pierre-Antoine-Ernest Bazin describe con más detalle la micosis fungoide y caracteriza el curso de la enfermedad. Un siglo más tarde, en 1979, el Instituto Nacional del Cáncer (E.E.U.U.) acuñó el término linfoma cutáneo de células T, englobando la micosis fungoide y el Síndrome de Sézary (2).
EPIDEMIOLOGÍA
La incidencia mundial es de aproximadamente 0,4 por 100.000 habitantes. Hay un predominio en varones mayores (edad media al diagnóstico de 55-60 años). También se han descrito casos en niños y adolescentes. Tiene una proporción hombre:mujer de 2:1. En España la incidencia anual es de 0,3-0,5 por 100.000 habitantes (3).
ETIOLOGÍA
La causa especifica de la micosis fungoide se desconoce. Se contempla la posible relación con la infección con el Virus 1 Linfotrópico T Humano (VLTH-1). Existe nueva evidencia de que tanto la inestabilidad genómica como cromosómica están involucradas en la génesis de este tipo de linfomas. Se han visto varias anormalidades tanto en el número como en estructuras de cromosomas sobre todo en estados avanzados, como son la pérdida del cromosoma 10q y anormalidades en la expresión de los genes de supresión tumoral como p15, p16 y p53 (4,5).
PATOGENIA
La micosis fungoide se trata de una proliferación monoclonal de linfocitos T cooperadores maduros de memoria CD4/CD45RO+, los cuales tienen alteraciones genómicas complejas y heterogéneas, que afectan a genes responsables de la activación, apoptosis, remodelación de la cromatina y de respuesta al daño del ADN, además de genes reguladores del ciclo celular (TP53, PLCG1, CARD11, STAT5B, NFKB2, IL6, ITPR1, RASA2, TNFRSF10A, FASN, ZEB1, DNMT3A o KMT2C), afectando así a las vías de señalización como STAT, NPTCH1 o beta- catenina. Este tipo de células tienen alto tropismo por las células que conforman la piel, por lo que sus efectos son más notorios en la piel que en otros órganos (6).
Se ha sugerido el papel de un antígeno crónico viral, desencadenante de la estimulación de los linfocitos CD4 por las células de Langerhans cutáneas. Otra teoría sugiere que la enfermedad se inicia con una fase de exacerbación en la cual los linfocitos T helper circulantes son reclutados en la dermis papilar, donde ocurre una selección de linfocitos T CD4 por citoquinas, la cual promueve la proliferación hasta determinadas poblaciones clonales causantes de la neoplasia (7).
CLASIFICACIÓN
También existe un espectro muy amplio de las variantes clínico-patológicas, recogidas por la OMS en 2016:
MANIFESTACIONES CLÍNICAS
La micosis fungoide está dividida, según las diferentes etapas que caracterizan la enfermedad en 3 estadios: Macular o eritematoso, placa y tumoral. También se abordará brevemente el Síndrome de Sézary (9).
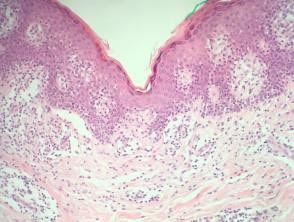
- Estadio macular (o eritematoso): en esta primera etapa suele presentar a nivel cutáneo placas o maculas descamativas eritemato-violáceas más o menos delimitadas. Estas lesiones pueden asociarse a intenso prurito o ser asintomáticas y pueden instaurarse arbitrariamente en cualquier parte del cuerpo. La evolución es de meses hasta años y las lesiones pueden incluso desaparecer espontáneamente sin dejar cicatriz. Se trata de una etapa de difícil diagnóstico, ya que existen otros muchos trastornos que se pueden manifestar de manera muy similar, pueden pasar años desde el inicio de esta etapa hasta el diagnóstico certero. Histológicamente, el hallazgo clásico es el infiltrado por epidermotropismo de las células T, que forman abscesos en la epidermis llamados “microabcesos de Pautrier”.
- Estadio de placas: puede ser la continuación de la anterior etapa o aparecer de novo. En la mayoría de los casos se evoluciona a una convergencia de las placas de diversas localizaciones. Histológicamente se puede encontrar hiperplasia epidérmica psoriasiforme, atrofia o bien ninguna alteración, con aumento del epidermotropismo y persistencia de los microabscesos de Pautrier. El infiltrado de linfocitos T se extiende profundamente por la dermis y planos más profundos. Pueden hallarse eosinófilos y células plasmáticas. Las papilas dérmicas presentan abundante fibrosis debido ala cronicidad de las lesiones. En esta etapa la biopsia es más concluyente para establecer el diagnóstico definitivo.
Imagen 4: Epidermotropismo. Hiperplasia epidérmica. Extensión dérmica de los infiltrados.
Imagen 5: Microabscesos de Pautrier.
- Estadio tumoral: es la fase de crecimiento vertical de placas previas o de novo, estas últimas sugiere invasión metastásica de células malignas. En esta etapa hay una predilección por la cara y pliegues. Hay presencia de nódulos y tumores que pueden ulcerarse e infectarse. La infiltración intensa suele dar lugar a facies leoninas y la confluencia de las lesiones puede ocasionar eritrodermia (inflamación exfoliativa generalizada de la piel). Conforme avanza la enfermedad es frecuente la aparición de queratodermia queratoplamar, pérdida de pelo y poiquilotermia (perdida de la capacidad de regulación de la temperatura corporal por fallo de la barrera cutánea). A medida que avanza la enfermedad, el pronóstico se va empobreciendo. Histológicamente, los tumores empiezan a formarse, con un infiltrado dérmico mucho más denso. Puede haber hallazgos de mitosis atípicas, células apoptóticas y pérdida de epidermotropismo. Las células tumorales aumentan en número y tamaño, apareciendo las características células cerebriformes.
Imagen 6: Tumores cutáneos con eritrodermia y ulceración.
Imagen 8: Infiltrado dérmico difuso.
- Síndrome de Sézary: es una forma de la micosis fungoide pero más avanzada, donde los linfocitos T neoplásicos se han extendido a la sangre periférica, ganglios linfáticos, médula ósea y otros órganos. Se caracteriza por la triada de eritrodermia, adenopatías y células cerebriformes (linfocitos atípicos) tanto en sangre periférica como en la dermis. Histológicamente no hay epidermotropismo. En la mayoría de los casos existe un ligero- moderado infiltrado de linfocitos en la dermis papilar, mezclada con bandas de fibras colágenas.
Imagen 9: Células cerebriformes en sangre periférica.
DIAGNÓSTICO
El diagnóstico precoz es complicado, debido a que en las fases iniciales los rasgos histológicos característicos como los microabscesos de Pautrier, los linfocitos atípicos y el epidermotropismo de la micosis fungoide aparecen en un 25%, 10% y 4% respectivamente.
Como pruebas complementarias necesarias para llegar al diagnóstico definitivo tenemos:
- Hemograma: puede haber alteración en el recuento de las tres líneas hemalótogicas.
- Frotis de sangre periférica: se podrán observar las células cerebriformes (si Síndrome de Sézary).
- Bioquímica estándar: LDH, beta-2 microglobulina.
- Serología (VIH, HTLV-1).
- Citometría de flujo de linfocitos T en sangre periférica.
- Radiografía de tórax, ecografía ganglionar.
- Biopsia cutánea y ganglionar.
- TAC, PET.
- Considerar biopsia de médula ósea.
- Pruebas cutáneas de contacto (Alergología).
La Sociedad Internacional de Linfomas Cutáneos desarrolló en 2005 un algoritmo diagnóstico basado en los hallazgos clínicos, histopatológicos, inmunohistoquímicos y moleculares para diagnosticar esta condición lo más precoz posible.
A parte de realizar estas pruebas, también hay que realizar conjuntamente una radiografía de tórax, TC completo, PET-TAC, biopsias de ganglios linfáticos y aspiración de médula ósea. Así, podemos determinar si la enfermedad se ha diseminado a otras partes del cuerpo y establecer un estadiaje correcto, en el que podemos basar el tratamiento.
Inmunofenotipo: Las células neoplásicas en la micosis fungoide son CD4+ monoclonales activadas, además, CD2+, CD3+, CD5+, CD7+ y CD8-. En algunos casos poco comunes también es posible identificar CD4- y CD8+.
ESTADIAJE
Para el estadiaje nos basamos en la clasificación TNM, nos guiará tanto en la extensión de la enfermedad, como en el tratamiento y el pronóstico.
Una vez establecido el TNM, podemos clasificar la enfermedad en los siguientes estadios (11) :
TRATAMIENTO
La modalidad terapéutica va a variar según el estadio clínico. Los estadios iniciales solo requieren tratamientos locales. Las terapias sistémicas se utilizan en pacientes que no responden a la terapia local o que están en estadios avanzados. El objetivo del tratamiento es la remisión, reducir la mortalidad y prevenir la progresión y las recidivas de la enfermedad (12).
Estadios IA, IB y IIA:
Terapias directas sobre la piel:
- Fotoquimioterapia PUVA: administración de psoraleno, un fotosensibilizador, acompañado de luz ultravioleta. Esta terapia puede generar remisiones por largos periodos. El efecto secundario más común son las náuseas. Se pueden conseguir respuestas en el 74%-90% de los casos.
- Fototerapia UVB: específica para la fase macular, ya que solo llega a las capas superficiales de la piel. Se pueden conseguir remisiones a largo plazo, aunque hay menos tasas de respuesta que con el tratamiento anterior.
- Corticoides tópicos: solo para el estadio macular. Respuesta global mayor de 80%. No exento de efectos secundarios.
- Radioterapia localizada.
- Mostaza nitrogenada tópica: abundantes efectos secundarios.
- Carmustina tópica: mielotoxicidad.
Terapias sistémicas:
- Bexaroteno: regula vías relacionadas con la proliferación, la diferenciación celular y la apoptosis.
- IFN2-alfa y 2-beta: remisión completa de un 25%. Tratamiento de mantenimiento disminuye recaídas y prolonga la remisión.
Estadio IIB:
- PUVA + IFN-alfa: respuesta en el 77% de los pacientes. Respuesta completa en el 33%.
- Radioterapia sistémica: espuesta completa mayor de 90% para los estadios I y II, y de 36% en el estadio IIB.
- Bexaroteno: respuesta global en 57% de los pacientes.
- Quimioterapia: respuestas parciales o completas en 81%.
Estadio III:
- PUVA + IFN-alfa
- Metotrexato
- Radioterapia
- Mostaza nitrogenada
- Fotoforesis extracorpórea
- Bexaroteno, Vorinostat, Denileukin de segunda línea.
Estadio IV
- Quimioterapia
- Radioterapia sistémica
- Bexaroteno
- Denileukin
- IFN-alfa
- Alemtuzumab (anti CD52)
- Metotrexato
PRONÓSTICO
El pronóstico es variable, está relacionado con el estadio de la enfermedad en el momento del diagnóstico definitivo y con la extensión de la enfermedad, además de la presencia de afectación extracutánea. Se estima que la sobrevida a 10 años es del 100% en estadíos T1, del 67% en T2, 39% en T3 y 41% en T4. La muerte de estos pacientes es comúnmente debido a sepsis generadas por pseudomonas o estafilococos en estadios tumorales, secundarias a infecciones crónicas de la piel por el estado de supresión (13).
CASO CLINICO
Paciente masculino de 67 años, agricultor, sin antecedentes personales o familiares de interés. Refiere 8 meses de evolución de un cuadro caracterizado por lesiones tumorales, localizadas principalmente en extremidades superiores e inferiores, cuero cabelludo y tronco. Estas mismas han ido aumentando de tamaño paulatinamente asociando además prurito. El paciente había sido tratado previamente con antihistamínicos y esteroides tópicos. Al examen físico se observaron a nivel de extremidades superiores, extremidades inferiores y tronco, lesiones maculares junto a placas eritemato-violáceas y tumoraciones bien delimitadas de diámetros entre 2 y 6 cm.
Los exámenes de laboratorio revelaron un hemograma con trombocitosis, leucocitosis y eosinofilia. La serología por virus de inmunosupresión humana (HIV) resultó negativa. Por otra parte, las pruebas de función hepática, renal, coagulación, glucemia, VSG y proteína C reactiva no presentaban alteraciones. En cuanto a los estudios de extensión, se realizó un TAC toracoabdominal; donde se evidenció la presencia de ganglios axilares bilaterales (los cuales fueron biopsiados). No se encontraron masas mediastínicas ni lesiones en otros órganos. Se le realizó aspirado de médula ósea, reportándose hiperplasia trilínea (glóbulos blancos, rojos y plaquetas), sin infiltración neoplásica.
Se tomaron biopsias de distintas lesiones, de tal forma que el examen histológico de la piel de la espalda reveló un proceso inflamatorio con predominio de linfocitos y eosinófilos; mientras que la muestra tomada de la región lumbar evidenció una tumoración que infiltra colágeno con participación de anexos, nidos de células inflamatorias con inmunología de células T CD4 (+). El diagnóstico final fue de micosis fungoide.
El paciente fue tratado mediante la combinación de PUVA, más quimioterapia sistémica.
BIBLIOGRAFÍA
1.- Girardi, M; Heald PW; Wilson LD. (mayo de 2004). «The pathogenesis of mycosis fungoides.». N Engl J Med. May 350 (19): 1978-88.
2.- Rigel, Darrell S; Robert Friedman, Leonard M. Dzubow, Douglas S. Reintgen, M.D., Jean- Claude Bystryn y Robin Marks (2006). Cáncer de piel. Elsevier, España. pp. 349-358. ISBN 8481748757.
3.- Bolognia L, Schaffer V, Cerroni L. Dermatología. Cuarta Edición. España: Elsevier; 2018. 2127-2139.
4.- Ferri, Fred F. (2006). Ferri consultor clínico, 2006-2007: Claves diagnósticas y tratamiento. Elsevier, España. p. 550. ISBN 8481749141.
5.- Fitzpatrick, T. Dermatology in General Medicine. McGraw-Hill Volumen II. Edición 6. 2005.
6.- J. Choi, G. Goh, T. Walradt, B.S. Hong, C.G. Bunick, K. Chen, et al. Genomic landscape of cutaneous T cell lymphoma. Nat Genet., 47 (2015), pp. 1011-1019.
7.- Vidarte Orrego, G., & EG, Á. L. (2008). Micosis fungoide en estadio de placas. Dermatol Perú, 18(2), 118-21.
8.- R. Willemze, L. Cerroni, W. Kempf, E. Berti, F. Facchetti, S.H. Swerdlow, et al. The 2018 update of the WHO-EORTC classification for primary cutaneous lymphomas. Blood., 133 (2019), pp. 1703-1714.
9.- Garzona Navas, L., Moreira Hidalgo, F., Hidalgo Matlock, B., & Siles Briceño, R. (2007). Micosis Fungoide: Revisión de tema y presentación de un caso. Revista Costarricense de salud pública, 16(30), 46-53.
10.- N. Pimpinelli, E.A. Olsen, M. Santucci, E. Vonderheid, A.C. Haeffner, S. Stevens, et al. Defining early mycosis fungoides. J Am Acad Dermatol., 53 (2005), pp. 1053-1063.
11.- E. Olsen, E. Vonderheid, N. Pimpinelli, R. Willemze, Y. Kim, R. Knobler, et al. Revisions to the staging and classification of mycosis fungoides and Sezary syndrome: a proposal of the International Society for Cutaneous Lymphomas (ISCL) and the cutaneous lymphoma task force of the European Organization of Research and Treatment of Cancer (EORTC). Blood., 110 (2007), pp. 1713-1722
12.- Valencia, O. J., Pérez, J. M., & Velásquez, M. M. (2010). Diagnóstico y manejo del linfoma cutáneo de células T de tipo micosis fungoides y síndrome de Sèzary. Revista de la Asociación Colombiana de Dermatología y Cirugía Dermatológica, 18(4), 205-217.
13.- Willemze et al. (2005) "Who-Eortc Classification For Cutaneous Lymphomas" Blood 105:10.









No hay comentarios:
Publicar un comentario
Se admiten comentarios que indiquen posibles errores en los textos y/o sugerencias de temas, y/o propuestas de mejoras en el blog y/o dudas sobre la realización de trabajos. Dado que este blog no es un consultorio médico, no se responderán preguntas realizadas con esa finalidad. Los comentarios que se consideren inapropiados, serán eliminados de inmediato, sin ningún tipo de excepción.