jueves, 20 de julio de 2023
¿Es un mito la inmortalidad?
‘Qui bene interrogat, bene diagnoscit;
martes, 11 de julio de 2023
Experiencia personal respecto al cáncer
Autor : Anónimo
4º Curso de Medicina (2022/2023)
Código de trabajo : 2217-XXX
¿Qué crees que siente un paciente joven que tiene una enfermedad de difícil curación –leucemia aguda, linfoma agresivo? ¿Cuáles son sus temores? ¿Hay algo que podríamos hacer para ayudarle a aceptar la enfermedad o a sobrellevarla mejor? ¿Qué harías tú si fueras el paciente?
Dado el carácter y la intención de este ejercicio, me voy a tomar la licencia de responder desde mi experiencia reciente. Con esto quiero aclarar, que pese a ser un proceso que he transitado de manera personal, puedo decir con franqueza que no existen dos personas iguales ni que lo vivan de la misma forma, por lo que considero que es difícil extraer conclusiones de carácter general en este aspecto, aunque es cierto que a la hora de compartir mis vivencias con otros pacientes supervivientes de cáncer, es frecuente encontrar ciertas similitudes.
Creo que es una situación sobre la que es difícil de hipotetizar al respecto, sobre como afrontar un diagnóstico de cáncer. Si me hubieran hecho esta pregunta hace dos o tres años, probablemente mi respuesta no se parecería en nada a la que siento que podría aportar ahora. Supongo que la reacción personal de cada uno es algo que solamente se puede constatar cuando te ves en una situación tan extrema.
En mi caso, aunque esto pueda sonar extraño o fuera de lo esperado, no sentí miedo de primeras con el diagnóstico, lo que sentí fue enfado. Concretamente, una especie de sentimiento de estafa vital. Lo verdaderamente doloroso del cáncer en una persona joven es que “no es lo esperable”. En una sociedad de meritocracia, donde se promueve la idea de que si te esfuerzas tendrás un buen trabajo, si te cuidas una buena salud, y si eres joven lo que te espera es un futuro prometedor, la palabra “cáncer” en una persona joven, que se cuidaba y sin antecedentes como era mi caso se me tornó la mayor de las injusticias.
Otro punto que se añade incrementando ese enfado es la impotencia. Existe una cierta tendencia cada vez más extendida de personalizar el cáncer, como si fuera un proceso sobre el cual tú estas dotado de cierto poder para su manejo. Afirmaciones enfocadas a que te mantengas positivo, o te cuides lo máximo posible, creo que están hechas con una buena intención pero claramente sesgadas. Cuando te ves inmerso en “este mundo”, por llamarlo de alguna manera, te das cuenta del poco control que tienes sobre la situación. No es que no puedas controlar como afrontar los tratamientos, lógicamente eso es algo que sí está en tu mano, pero en cualquier caso, el resultado final de ese camino está invariablemente en su mayoría de veces fuera de tu alcance. Y ahí nuevamente se perpetúa ese sentimiento de injusticia, porque puedes darlo todo y que no salga bien, o que sí lo haga. Pero no está del todo en tu mano.
Yo en cierta manera, decía que el proceso oncológico era lo más parecido a un salto de fe. Te ves y sientes el deterioro en tu cuerpo tras cada ciclo, al cual tienes que volver religiosamente sabiendo que te sentará horrible pero convencida de que es por un bien mayor. Cuando terminas, tu estado se ha modificado tanto en tan pocos meses, que te resulta complicado pensar que se pueda volver de nuevo a como te sentías cuando estabas en la casilla de salida. Y esto es algo que me gustaría puntualizar. Creo que uno de los grandes miedos del superviviente de cáncer y más joven, es cuando se obsesiona con esta idea de “volver a ser como antes”. A mí me pasó, y a día de hoy todavía me sigue pasando, pero creo que es algo que hay que aclarar de entrada. No necesariamente se tiene que volver a como se estaba antes, a veces a nivel físico, otras a nivel mental, muchas veces un poco de ambas, y esto tampoco se debería de ver como algo malo o un fracaso. Supone entender que es un proceso demasiado intenso como para pretender fingir que nunca ha pasado. Y esto a veces me ha generado cierto sentimiento de culpa, emoción que me acompañó durante el diagnóstico reciente, tratando de responder inútilmente a la cuestión de ¿por qué a mí?, y después, martirizándome por realcanzar una versión anterior mía idealizada.
Hay una frase que dijo Julia Otero tras haber superado un cáncer de colon, con la cual me sentí muy identificada que era, “morir no te da miedo, lo que te da es pena”, realmente la forma de morir es algo que puede suscitar temor, pero al final el hecho de saber que tu vida puede tener un final abrupto y prematuro lo que te genera es un sentimiento de desesperanza y tristeza, porque todo lo que se te prometió y que tu tenias expectativas de vivir, de repente se vuelve difuso e inconcluso. Sencillamente el tiempo se suspende, y hasta que no se reanuda, tu futuro hipotético sencillamente se esfuma. A día de hoy todavía me cuesta imaginar muy a futuro, al menos ya no como lo podía hacer antes.
Es cierto que tras una experiencia así vives necesariamente mucho más al día, pero al mismo tiempo supone también que te arranquen esa inocencia de invulnerabilidad juvenil. Sea como fuere, en cualquier caso no es algo que te deje indiferente, y creo que es importante concienciar sobre ello más aún cuando se es joven, dado que toda la experiencia resulta mucho más intensa, aunque como digo los miedos son algo personal. A la que es madre le aterrará dejar a sus hijos atrás, al abuelo no poder ver más a sus nietos, y a los más jóvenes nos aterra no ver más a nuestro seres queridos en general, pero también no poder materializar todos los encuentros futuros y planes que podríamos tener, es la perspectiva de una posible vida truncada, y eso es lo que quizás resulte más traumático de todo.
Al menos en mi caso sí que he podido percibir que la manera de dirigirse a mí no ha sido la misma que a la de otros pacientes de más edad, supongo que no es una cuestión de preferencias, pero sí de que resulta más “antinatural”. Nadie está preparado para ver a alguien más joven que tú irse, porque no es “ley de vida”.
Sin embargo supongo que no todo es malo después de todo. Es verdad que las probabilidades de que pudiera pasarme algo así eran ínfimas, y que aún tengo días en los cuales pataleo o me vengo abajo, más aún cuando percibo que las secuelas me acompañan o me pesan más que otros días, cuando me encuentro más cansada, o más lenta de lo que debería, o me da pinchazos en el brazo que me quitaron ganglios o sencillamente cuando me veo la cicatriz de la cirugía.
Pero dentro de todo he sido y soy afortunada. No voy a romantizar el cáncer ni todo lo que le rodea. Tampoco coincido en esta mentalidad a veces un tanto forzada de que parece que tuvieras que estar agradecido con la vida tras haber pasado un cáncer. No me siento agradecida ni agraciada. No es algo que quisiera pasar, pero supongo que al final la necesidad de dotarle de algún tipo de sentido te hace intentar verle alguna clase de aportación a tu vida, más allá de la evidente parte negativa.
Creo que en cierto orden de cosas, más allá de que en el plano personal ciertamente relativizo las cosas algo más (también por su contraparte arrastro más miedos e inseguridades que antes), pienso que en donde más me ha podido reportar un sentido positivo puede ser a la hora de entender mejor a la gente que ha pasado por esto, y por ende, en el plano profesional de cara a lidiar con pacientes oncológicos. Esto no quiere decir necesariamente que me vaya a dedicar a la atención oncológica, pero tampoco creo que deba de ser una puerta que tenga que cerrar. Con el tiempo se verá.
Como conclusión, me gustaría destacar dos notas positivas: que pese al mal pronóstico de entrada con el que contaba tengo la inmensa suerte de haberlo superado, y que en todo momento estuve arropada por un estupendo equipo y me sentí muy afortunada de que así fuera. Quiero recalcar que si la confianza que inspira un médico es necesaria en todos los ámbitos y especialidades, el peso emocional de esos encuentros, en el caso del paciente oncológico se multiplican, y más al inicio de la enfermedad. Soy consciente de la enorme responsabilidad que alberga eso, dado que yo misma recuerdo cada palabra y cada gesto con nitidez. Como digo, todo adquiere otra dimensión, y lo que para el médico puede suponer un gesto amable sin más, para el paciente le puede suponer sobrellevar su día o su semana mucho mejor, y también al revés.
Es cierto que puede resultar complicado consolar en momentos así, de hecho yo misma sentía que no había ni existían palabras de consuelo para mí en esos momentos, pero puede que la fórmula sea mucho más sencilla que eso: acompañar y validar. Me he dado cuenta que en la mayoría de casos no se pretende dar una solución al problema, sino que más bien se ofrece de manera desbocada por no tener que lidiar con la incomodad de tu malestar.
Me di cuenta durante esos meses, que sostener el malestar de una situación así era difícil, la gente no sabe que decir, así que decían lo que creían que era mejor conforme lo que sabían, y muchas veces impregnado de sentimientos de pena y compasión. No hay peor que te puedan mirar con pena o lástima, y es una de las cosas que mas he aprendido de cómo no habría que dirigirse a un paciente oncológico. Lo segundo, es que muchas veces no se trata de darle una solución porque puede que no la haya. O de mitigar ciertas cosas porque son lo que son. Yo aprecié mucho que todo se me explicó de forma amable pero sin tapujos. Y lo tercero es que ante el malestar del paciente, a veces resulta suficiente con validarle como se siente. Tratamos continuamente de mantener la compostura, permanecer fuertes para soportar las vicisitudes del tratamiento, y nos sentimos culpables si no actuamos conforme a las expectativas.
Porque incluso para los pacientes de cáncer hay expectativas. Y a veces el mayor consuelo es darles la tranquilidad de que se dejen ser. Permitirse llorar si hace falta para después continuar, un poco más liviano que antes, e ir dando un paso cada vez.
Y lo mas importante, es que después sepan que el cáncer no es el punto y final, es un punto y seguido.
lunes, 3 de julio de 2023
Fisiopatología molecular de los síndromes mieloproliferativos
INTRODUCCIÓN
Neoplasias Mieloproliferativas Filadelfia POSITIVAS
Leucemia mieloide crónica
NMP sin presencia de la translocación t(9;22)
Mutaciones driver de NMP
JAK2 La Cinasa Janus 2 ( JAK2)
CALR
MPL
BIBLIOGRAFÍA
1. Quesada Dorta, Marlene, Pantaleón Florido, Gretta, Bello Álvarez, Daisy, Casanueva Calero, Karina, & Carnot Uría, José. (2011). Resultados citogéneticos en pacientes con leucemia mieloide crónica. Revista Cubana de Medicina, 50(4), 341-347. Recuperado en 14 de junio de 2023, de http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75232011000400002&ln g=es&tlng=pt.
2. Rumi E, Cazzola M. Diagnosis, risk stratification, and response evaluation in classical myeloproliferative neoplasms. Blood. 2017;129(6):680–692.
3. Lens, Daniela, Muxi, Pablo, Brugnini, Andreína, Trías, Natalia, & Pierri, Silvia. (2007). Determinación de la mutación V617F del gen JAK2 en los síndromes mieloproliferativos crónicos en nuestro país: a propósito de un caso. Revista Médica del Uruguay, 23(2), 122-125. Recuperado en 14 de junio de 2023, de http://www.scielo.edu.uy/scielo.php?script=sci_arttext&pid=S1688-03902007000200 008&lng=es&tlng=es.
4. Carreño Gómez-Tarragona, Gonzalo (2021) Bases moleculares de las neoplasias mieloproliferativas crónicas filadelfia negativas.UNIVERSIDAD COMPLUTENSE DE MADRID FACULTAD DE MEDICINA
5. Lindauer K., Loerting T., Liedl K.R., and Kroemer R.T. (2001). Prediction of the structure of human Janus kinase 2 (JAK2) comprising the two carboxy-terminal domains reveals a mechanism for autoregulation.Protein Eng 14: 27-37.
6. Gari, Mamdooh. (2009). The Role of Janus Kinase 2 (JAK2) in the Pathologenesis of Myeloproliferative Disorders. Journal of King Abdulaziz University-Medical Sciences. 16. 10.4197/Med.16-1.1.
7. Nangalia J, Green AR. Myeloproliferative neoplasms: From origins to outcomes. Hematology. 2017;2017(1):470–479.
viernes, 23 de junio de 2023
Trombocitemia esencial
INTRODUCCION
PATOGÉNESIS
EPIDEMIOLOGÍA
CLÍNICA
DIAGNÓSTICO
EVALUACION DIAGNÓSTICA
CRITERIOS DIAGNÓSTICOS
- Trombocitosis persistente > 450x109/L
- BMO con predominio de megacariocitos maduros y de gran tamaño con núcleo hiperlobulado, sin incremento significativo o desviación a la izquierda de la granulopoyesis o eritropoyesis y muy infrecuente incremento de la reticulina (MF1)
- No evidencia según los criterios diagnósticos de la OMS de PV, MF primaria, LMC, SMD u otra neoplasia mielodie.
- Demostración de la mutación JAK2 V617F, CALR o MPL
- Presencia de un marcador clonal ((mutaciones ASXL1, EZH2, TET2, IDH1/IDH2, SRSF2 o SRF3B1) y ausencia de causas de trombocitosis reactiva.
ESTRATIFICACIÓN DEL RIESGO
- Edad ≥60 años y/o
- Antecedentes de trombosis
- Edad <60 años, y ausencia de historia de trombosis
Figura 3. Sistemas de estratificación de riesgo trombótico en TE. Extraído de Advances in Hematology. Volume 2020. (Click en la imagen para aumentar tamaño)
PRONÓSTICO
DIAGNOSTICO DIFERENCIAL
- Neoplasias mieloproliferativas Filadelfia negativas
- Síndromes mielodisplásicos con trombocitosis
- Trombocitosis secundarias o reactivas (ferropenia, esplenectomía, infecciones, inflamación crónica, cirugía, neoplasias asociadas…)
TRATAMIENTO
OTROS TRATAMIENTOS
BIBLIOGRAFÍA
jueves, 15 de junio de 2023
Enfermedad hemolítica perinatal
INTRODUCCIÓN
ETIOLOGÍA
- Por transfusiones.
- Por drogadicción endovenosa.
- Por parto, aborto, embarazo ectópico, amniocentesis, biopsia corial, traumas abdominales…
- Durante el embarazo, debido a pequeñas hemorragias placentarias que hacen que los eritrocitos fetales entren a la circulación de la madre.
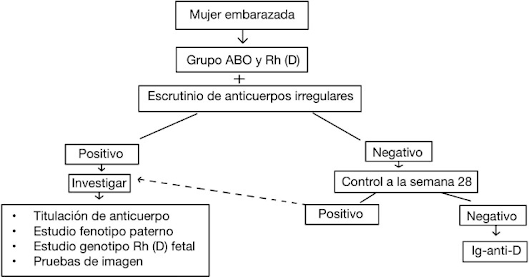
DIAGNÓSTICO Y EVALUACIÓN INICIAL
- Test de Coombs indirecto: es la prueba principal a realizar al inicio del embarazo, independientemente del Rh de la madre. Esta prueba sirve para detectar a pacientes con anticuerpos anti-D y otros anticuerpos irregulares. Mediante esta prueba se detecta la presencia de IgG. En las madres que se han sensibilizado durante el embarazo existe buena correlación entre títulos bajos <1/16 y enfermedad leve. A partir de títulos ≥1/16 encontraremos EHP grave (4).
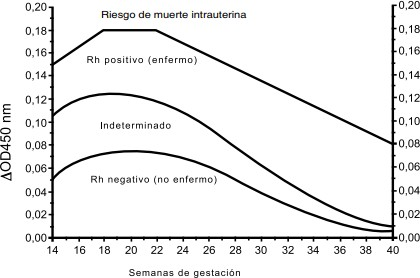
- Espectrofotometría de bilirrubina en líquido amniótico: el pigmento presente en el líquido amniótico que le da una tonalidad amarilla es bilirrubina indirecta. Es posible cuantificarla y se correlaciona inversamente con el hematocrito del feto. La medición se hace por espectrofotometría, y se confecciona una curva (curva de Liley) que permite el manejo de la enfermedad sobre la semana 28 de embarazo. Hoy en día no se suele utilizar por su imprecisión antes de la semana 26. Además, esta técnica requiere obtener líquido amniótico por amniocentesis, que se realiza guiada por ultrasonidos, evitando el paso transplacentario, que supone un riesgo. Los resultados se pueden alterar por contaminación con sangre materna o fetal, y por exposición a la luz de la muestra. En esta curva encontramos tres zonas, una de ellas (la zona B) dividida en dos. Relaciona la condición del feto con los niveles de hemoglobina:
- Ecografía: es imprescindible para el manejo de la EHP. Con ella podemos diagnosticar la edad gestacional, realizar transfusiones intrauterinas, amniocentesis guiadas… Además, una vez establecida la enfermedad, podemos evaluar si hay signos tempranos de hidrops.
- Velocimetría Doppler de la arteria cerebral media (ACM): La velocidad en este vaso sanguíneo aumenta cuando cae el hematocrito ya que disminuye la viscosidad de la sangre y hay un hiperdinamismo de la circulación del feto. Las ventajas de esta técnica son que se trata de un procedimiento no invasivo, precoz y sensible.
- Cordocentesis o funiculocentesis: lo ideal para conocer los niveles de hemoglobina del feto es obtener sangre del feto. Es la prueba de elección cuando se necesita saber los niveles de anemia fetal. Para ello se identifica el cordón umbilical del feto y se aspira la sangre por medio de una jeringa. El sitio ideal para realizarla es la vena umbilical en la placenta.
EVALUACIÓN Y TRATAMIENTO DEL FETO
- Hemólisis y anemia (problema clave).
- Eritropoyesis extramedular, fundamentalmente en el hígado.
- Hipertensión portal y ascitis.
- También puede aparecer insuficiencia cardíaca, hipoalbuminemia, hipoxia...
MANEJO DEL RECIÉN NACIDO
- En la enfermedad leve los RN no requieren tratamiento especial. Son sanos y sobreviven un 100%.
- En la enfermedad moderada, el RN no está hidrópico, pero desarrolla rápidamente hiperbilirrubinemia indirecta. Esta puede fijarse a los núcleos de la base y dar lugar a un proceso neurológico grave (kernícterus), el cual tiene una mortalidad del 90% si no se trata. Cursa con espasticidad, postración y convulsiones, y puede dejar lesiones irreversibles.
- En la enfermedad severa encontramos el hidrops fetal. La mitad de las veces antes de la semana 34, y el resto después. Sin tratamiento la mortalidad es del 100%.
- Fototerapia en caso de que los niveles de bilirrubina >9mg/dL en las primeras 24 horas o >14mg/dL entre las 24-48 horas.
- Exanguinotransfusión si bilirrubina >10mg/dL en las primeras 24 horas, >15mg/dL entre las primeras 24-48 horas o ≥20 mg/dL en cualquier momento. Se realizará con sangre que tenga menos de 5 días, grupo 0, Rh negativa, irradiada y filtrada, y plasma AB. El volumen medio a recambiar es de 170 mL/kg de peso, intentando alcanzar un hematocrito de 45-55%. El objetivo de este tratamiento es eliminar la bilirrubina indirecta, eliminar el anticuerpo de la circulación del neonato y tratar la anemia. Además, podemos administrar albúmina una hora antes de la exanguinotransfución, ya que permite eliminar un 40% adicional de bilirrubina.