Autora : Eva Sánchez Yébenes4º Curso Medicina grupo C (curso 2020/2021)Código de trabajo : 2005-ESY
DEFINICIÓN
En condiciones normales, se dispone de cuatro copias del gen de la globina a, dos de ellas en cada una de las cromátidas del cromosoma 16, las cuales son esenciales para la síntesis de la hemoglobina, tanto fetal (HbF) como del adulto (HbA y HbA2). En contraste, solo hay dos copias del gen de la globina β, una en cada una de las cromátidas del cromosoma 11, necesaria para la formación de la HbA.
Las talasemias se definen como un grupo de trastornos, cada uno resultado de un defecto hereditario en la tasa de síntesis de una o más cadenas de globina produciendo un fallo cuantitativo de ellas, afectando, por tanto, a la síntesis de hemoglobina; considerándose así una hemoglobinopatía hereditaria, caracterizada por la disminución o la ausencia de síntesis de una cadena de globina que determinará una menor hemoglobinización de los precursores eritroides y hematíes maduros, así como un desequilibrio entre las cadenas deficitarias y no deficitarias.
CLASIFICACIÓN
Dichos trastornos se clasifican dependiendo de la cadena de globina que deje de sintetizarse, originando:
α-talasemia: debido al déficit de síntesis de las cadenas α, con un exceso de las cadenas β. Se deben a eliminaciones de un gran segmento del gen de la globina α (deleciones) por cruzamiento desequilibrado o recombinación y, con menos frecuencia, por mutaciones. Los segmentos eliminados del ADN tienen un tamaño variable y puede estar afectado uno de los alelos de la misma cromátida o los dos. Dependiendo del número de genes (de uno a cuatro) que afecte pueden clasificarse en: α-talasemia silente (1 gen), α-talasemia menor (2), hemoglobinopatía H (3) y hemoglobinopatía de Bart (4).
β-talasemia: debido al déficit de síntesis de las cadenas β, con un exceso de las cadenas α. Se produce generalmente debido a mutaciones del gen β (cambio de bases nitrogenadas de la cadena β) afectando al funcionamiento del ARN. Se observan dos tipos: β-talasemia menor (minor; estado heterocigoto, una mutación) y β-talasemia mayor (major; estado homocigoto). Este último será el trastorno en el que nos centraremos en este tema.
βδ-talasemia: se produce cuando hay un déficit de más de una cadena (βδ).
EPIDEMIOLOGÍA
Las mutaciones de la β-talasemia mayor se agrupan por localización étnica regional: cuenca mediterránea, Medio Oriente, Paquistán, sudeste asiático, en focos aislados en África Occidental (sobre todo en Liberia y en partes de África del Norte) e India. Debido a la alta migración son cada vez más comunes en América del Norte, pero también del Sur. La prevalencia de portadores de talasemia en esta región es de 2,5-15%. Además, existe una fuerte evidencia indirecta de que la alta frecuencia de estos trastornos se ha mantenido por la protección que crean contra la malaria por Plasmodium falciparum, produciendo una enfermedad más leve y con un menor impacto en la capacidad reproductiva. La incidencia se estima en 1 de cada 100.000 habitantes por año, mientras que es de 1 cada 10.000 habitantes en la Unión Europea.
ETIOLOGÍA, PATOGENIA Y FISIOPATOLOGÍA DE LA β-TALASEMIA MAYOR
La β-talasemia mayor o también llamada anemia de Cooley es el fenotipo de reducción grave de los dos alelos de la cadena β de la globina, en la cual la síntesis de cadenas β (y de HbA) está virtualmente ausente, con un gran exceso de las cadenas α y, en consecuencia, anemia hemolítica grave. Se produce un aumento compensador de HbF y de HbA2 que es inadecuado para compensar la ausencia de producción de cadenas β. Se han descubierto más de 150 mutaciones de genes β-talasémicos que se identifican por métodos de biología molecular. La mayoría de estos defectos moleculares corresponden a mutaciones puntuales de un único nucleótido o inserciones o deleciones de pocos nucleótidos que van a alterar uno de los mecanismos moleculares involucrados en la expresión del gen, como son la transcripción, el procesamiento del pre-ARNm y la traducción.
De esta forma, las mutaciones que afectan a la trascripción se localizan en la zona promotora, las que afectan al procesamiento del ARN se localizan fundamentalmente en los intrones y en las zonas 5’ y 3’ UTR y, las que afectan a la traducción, grupo más frecuente, se localizan en los exones, aunque también se han descrito mutaciones en los exones que no interfieren en la traducción, sino en el procesamiento del ARNm al formarse nuevas zonas consenso del splicing.
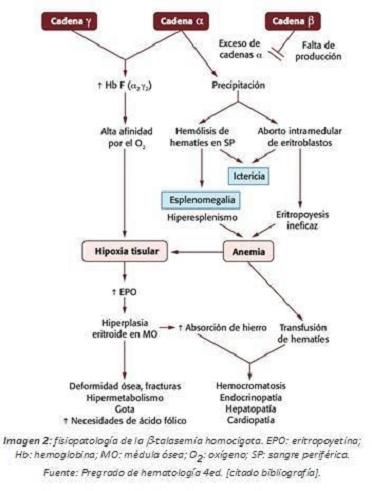
Se produce un desequilibrio entre las cadenas α no deficitarias y las β deficitarias, constituyendo el factor más importante en la expresión fenotípica. Cuanto mayor sea este desequilibrio de dichas cadenas, mayor será la expresión fenotípica, de tal manera que será máxima en las talasemias mayores. Por tanto, la expresividad clínica es variable, pero generalmente muy intensa.
Las manifestaciones clínicas se producen debidas a la anemia y a la eritropoyesis ineficaz. La anemia estimula la síntesis de eritropoyetina, y esta a su vez aumenta la eritropoyesis ineficaz determinada por la precipitación de las cadenas a no deficitarias, que inducen la apoptosis de los precursores eritropoyéticos y hemólisis. Se originan eritrocitos microcíticos e hipocrómicos que resultan de la reducción general de la síntesis de hemoglobina.
La síntesis de hemoglobinas F y HbA2 no debe verse afectada. La producción de HbF en el útero es normal. Las manifestaciones clínicas de la talasemia aparecen solo cuando ocurre el cambio neonatal de la producción de cadenas γ a β (cambio de HbF a HbA) que comienza a manifestarse a partir del quinto y sexto mes de vida.
MANIFESTACIONES CLÍNICAS DE LA β-TALASEMIA MAYOR
Dado que la HbF no contiene cadenas β, los niños se encuentran clínicamente normales en el momento del nacimiento, la anemia se desarrolla en los primeros meses de la vida, se vuelve progresivamente más grave y coincide con el cambio de cadenas γ a β. Durante los dos primeros años de vida estos pacientes presentarán palidez (hipoxia tisular), irritabilidad, alteraciones en el sueño, rechazo del alimento e infecciones de repetición. La anemia produce una detención del crecimiento, ictericia (hemolisis de los eritrocitos en sangre periférica) y hepatoesplenomegalia (por la hematopoyesis extramedular que se produce, que puede originar complicaciones neurológicas), aumenta la pigmentación de la piel. Con la esplenomegalia macroscópica puede desarrollarse con frecuencia trombocitopenia y leucopenia secundarias, lo que lleva a una mayor tendencia a la infección y al sangrado.
La intensa anemia y el aumento de la HbF (tiene una alta afinidad por el O2) generan una hipoxia tisular crónica que genera un aumento importante de eritropoyetina, produciendo una gran hiperplasia medular que acarrea un aumento de la absorción del hierro (hemosiderosis secundaria) y alteraciones en el sistema óseo con deformidades y fracturas espontáneas (por rarefacción ósea, expansión de las cavidades medulares con adelgazamiento de huesos largos y cráneo). Afectan al cráneo produciendo cráneo “en cepillo”, adelgazamiento de la cortical, a la facies (facies mongoloide, prominencia de la mandíbula) produciendo problemas dentales por maloclusión, a la columna y a las extremidades. Se pueden producir cardiopatías por efecto de la anemia y la hemosiderosis, que pueden ocasionar la muerte del paciente.
Los niños que han crecido y se han ido desarrollando normalmente durante los primeros 10 años de vida debido al correcto tratamiento (lo veremos más adelante) pueden desarrollar diversas alteraciones endocrinas, en particular diabetes mellitus, hipogonadismo hipogonadotrófico y deficiencia de la hormona del crecimiento. Menos comunes son el hipotiroidismo y la insuficiencia suprarrenal. La osteoporosis se reconoce cada vez más y puede, al menos en parte, ser un reflejo del hipogonadismo.
DATOS DE LABORATORIO
La anemia que se produce es grave, con valores de Hb entre 3 y 6 g/dL con VCM y HCM bajos. En el frotis de sangre periférica, los hematíes son muy hipocrómicos y microcíticos, con importante punteado basófilo y dianocitosis. También hay eritroblastos circulantes e intensa anisopoiquilocitosis; los reticulocitos están ligeramente aumentados para suplir la anemia. El patrón electroforético muestra que la mayor parte de la Hb es HbF (60-98%), un porcentaje pequeño de HbA2 y una cantidad escasa de HbA. La resistencia osmótica está aumentada.
En la médula ósea, hay hiperplasia eritroide con diseritropoyesis y un aumento importante de los depósitos de hierro, que se observa mediante la tinción de Perls.
Entre otros datos, cabe destacar que habrá un aumento de la bilirrubina indirecta y urobilinógeno como consecuencia de la hemólisis que se produce en la sangre periférica. La sobrecarga de hierro se reflejará con un incremento del hierro y la ferritina séricos, y una disminución de la cantidad de fijación total de la transferrina. Puede haber también disfunción endocrina y de hemosiderosis de órganos como el páncreas, el hígado o el miocardio.
Imagen 4: frotis de sangre periférica de b-talasemia, donde se observa anisopoiquilocitosis, dianocitos y eritroblastos circulantes. Fuente: Pregrado de hematología 4ed. [citado bibliografía].
Con respecto a los estudios radiológicos, la radiografía de cráneo es típica, en la que se observa el cráneo en cepillo. A veces, una radiografía simple de abdomen o una ecografía pueden mostrar cálculos biliares, como consecuencia del catabolismo de la bilirrubina. En la resonancia magnética se puede ver la valoración de los depósitos de hierro hepático, también, a nivel cardíaco se miden dichos depósitos.
DIAGNÓSTICO
Actualmente, el diagnóstico de las talasemias se realiza mediante estudio neonatal o prenatal. Sin embargo, el objetivo del estudio posnatal es identificar a los portadores de talasemia β y otras hemoglobinopatías importantes desde el punto de vista clínico. Se empieza con un hemograma completo; cuando los índices eritrocitarios son indicativos, así como, el frotis de sangre periférica y la cromatografía de líquidos de alto rendimiento se ofrece un diagnóstico provisional. Éste se confirma por electroforesis en gel en medio alcalino o ácido que separa las diferentes hemoglobinas.
Imagen 5: características hematológicas de la β-talasemia. Fuente: Manual de hematología clínica 4ed. [citado bibliografía].
Imagen 6: esquema diagnóstico para la talasemia. Fuente: Manual de hematología clínica 4ed. [citado bibliografía].
DIAGNÓSTICO DIFERENCIAL
En la niñez, las anemias sideroblásticas hereditarias pueden parecerse a la talasemia, pero el examen de la médula ósea permite la diferenciación. También se puede confundir con la leucemia mielomonocítica crónica por los niveles de hemoglobina fetal, pero el examen de médula ósea ha de ser definitivo.
Imagen 7: diagrama de flujo en el que se muestra una aproximación al diagnóstico de los síndromes talasémicos. Fuente: Williams Manual de hematología 8ed. [citado bibliografía].
PRONÓSTICO
Las complicaciones cardíacas se redujeron de forma drástica en los pacientes que reciben tratamiento adecuado mediante transfusiones y quelación de hierro. El trasplante de célula madre hematopoyética proveniente de un hermano donante con HLA idéntico y efectuado de manera temprana en la vida puede conducir a la curación.
PREVENCIÓN
Para el diagnóstico prenatal, se hace detección materna en la primera visita de control prenatal; si la madre es una portadora de talasemia hay que hacer detección paterna; si ambos son portadores del gen de una forma grave de talasemia, se les ofrece una prueba diagnóstico prenatal y la interrupción del embarazo. Se puede hacer con una muestra de vellosidad coriónica a las nueve semanas y análisis del ADN fetal.
TRATAMIENTO
El tratamiento de dicha patología requiere un alto estándar de atención pediátrica, tratamiento temprano de las infecciones y atención dental debido a las deformidades óseas del cráneo. Además de esto, una parte esencial en el tratamiento de las formas graves consiste en la prevención de las formas homocigotas mediante el diagnóstico precoz de los portadores, consejo genético y diagnóstico prenatal.
La base del tratamiento es la transfusión periódica de hematíes para corregir la anemia y quelantes del hierro para prevenir la siderosis y hemocromatosis.
Un criterio suficiente para iniciar las transfusiones es la presencia de Hb <7 g/dl durante más de dos semanas, con exclusión de otras causas concomitantes. Cuando el paciente tenga Hb>7 g/dl es necesario además que porte otros factores que pueden indicar la necesidad de un soporte. La actitud terapéutica es hipertransfundir a estos niños, manteniéndoles siempre con Hb superiores a los 9-10 g/dl, lo que asegura una buena calidad de vida, y sin síntomas, y asegurando, por tanto, un desarrollo psicofísico armónico. Hay que transfundirlos cada 2-4 semanas, y se deben registrar cuidadosamente los niveles de Hb pretransfusionales. Las transfusiones se pueden dividir en simples, crónicas simples y exanguinotransfusiones. De forma ideal, las transfusiones deben realizarse con hematíes lavados o filtrados, para evitar las reacciones inmunes y las aloinmunizaciones. Cuando los requerimientos transfusionales son muy asiduos puede ser necesaria la esplenectomía seguido del alargamiento del período intertransfusional. Una complicación inevitable importante de las transfusiones es la hemosiderosis, por lo que tiene que asociarse a una quelación. Esta adecuada oxigenación tisular que producen las transfusiones reduce, en parte, la hiperplasia eritroide patológica y evitará la desmineralización ósea, así como no se producirá el hiperesplenismo. Debe mantenerse un historial transfusional detallado que incluya el número total de unidades previas de eritrocitos, la presencia de cualquier anticuerpo contra éstos y el objetivo de la hemoglobina.
Como habíamos comentado, es necesario una quelación de hierro, así mantendrán una supervivencia significativamente mejor. Debe empezarse generalmente después de los 2 años de edad, cuando el paciente haya recibido 10-20 transfusiones o cuando la ferritina es >1000 mg/l o cuando la concentración de hierro hepático es superior a 3 mg Fe/g de peso seco de tejido hepático. Disponemos de tres quelantes de hierro: deferoxamina, deferiprona y deferasirox.
La esplenectomía debe plantearse a los niños mayores de 5 años cuando las necesidades de sangre superan los 200 a 220 ml de eritrocitos/kg al año, especialmente si el bazo supera los 6 cm por debajo del reborde costal, si la esplenomegalia es masiva y sintomática, y si, además, el niño tiene neutropenia y trombopenia por hiperesplenismo. Se produce una asociación con un incremento de infecciones y fenómenos trombóticos.
En estos pacientes, el único tratamiento curativo es el trasplante de médula ósea alogénico, que debe plantearse en los casos más graves. El trasplante se realiza a partir de un hermano HLA idéntico, obteniendo una supervivencia libre de enfermedad del 94%; estos datos han mejorado debido al empleo del tratamiento inmunosupresor pretrasplante. Sin embargo, los resultados del trasplante con donantes no emparentados son peores, aunque han mejorado con la selección de donantes HLA compatibles por técnicas de alta resolución. También se puede hacer el trasplante con la sangre de cordón umbilical que produce un menor riesgo de enfermedad de injerto contra receptor.
Otros tratamientos experimentales que han dado buenos resultados en ensayos clínicos iniciales, son el uso de diversos fármacos como hidroxiurea, azacitidina, decitabina y los derivados de ácidos grasos de cadena corta (fenilbutirato y butirato), que por una serie de mecanismos inducen la expresión de los genes que codifican las cadenas g, con lo que se disminuiría el desequilibrio entre cadenas de tipo a y de tipo β.
BIBLIOGRAFÍA
1. Matthew M. Hsieh, John F. Tisdale, Rodgers Griffin P. Anemia drepanocítica y talasemia. En: Bethesda Manual de Hematología Clínica (pp. 63-90). 4a ed. Barcelona: Wolters Kluwer; 2018. p. 697.
2. A. González G. Martín Núñez. Hemoglobinopatías. Talasemias (pp. 123-155). En: Pregrado de Hematología. 4a ed. Madrid: Luzán 5, S.A.; 2017. p. 736.
3. Orphanet: Beta talasemia mayor [Internet]. [citado 21 de diciembre de 2020]. Disponible en: https://www.orpha.net/consor/cgi-bin/OC_Exp.php?lng=ES&Expert=231214
4. John Chapin, Patricia J. Giardina. Thalassemia syndromes. En: Hematology Basic Principles and Practice (pp. 546-570). 2018. 7a ed. Elsevier; p. 2408.
5. David J. Weatherall. The Thalassemias: Disorders of Globin Synthesis (pp. 725-758). En: Williams Hematology. 9a ed. McGrawHill Interamericana de España; 2016. p. 2505.
6. Marshall A. Lichtman, Kenneth Kaushansky, Thomas J. Kipps, Josef T. Prchal, Marcel M. Levi. Williams. Manual de Hematología (pp. 80-87). 8a ed. México: McGrawHill Interamericana de España; 2014. 760 p.






No hay comentarios:
Publicar un comentario
Se admiten comentarios que indiquen posibles errores en los textos y/o sugerencias de temas, y/o propuestas de mejoras en el blog y/o dudas sobre la realización de trabajos. Dado que este blog no es un consultorio médico, no se responderán preguntas realizadas con esa finalidad. Los comentarios que se consideren inapropiados, serán eliminados de inmediato, sin ningún tipo de excepción.
Nota: solo los miembros de este blog pueden publicar comentarios.