4º curso de Medicina grupo "A" (curso 2024-25)
Código de trabajo : 2403-CCA
Linaje celular de los trombocitos
INTRODUCCIÓN
Linaje celular de los trombocitos
La megacariocitopoyesis es la línea de diferenciación celular, dentro de la hematopoyesis, encargada de la producción de los megacariocitos. Se produce cuando las “stem cell” (células multipotentes capaces de diferenciarse en todos los tipos celulares hematológicos) se diversifican a un progenitor mieloide común y a su vez a un progenitor común de megacariocitos y eritrocitos. (Véase Ilustración 1)
Los progenitores megacariocíticos se dividen por mitosis en fases iniciales del proceso, tras lo cual sufren una fase endomitótica (mitosis nuclear, pero sin división celular). Las sucesivas duplicaciones del ADN originan unas células poliploides (4N hasta 64N). Los megacariocitos, que oscilan entre 40 a 100 micras de diámetro, son unas de las células más grandes de la médula ósea. En la fase final de la megacariocitopoyesis, se produce la maduración del citoplasma, que dará lugar, mediante el proceso de la trombocitopoyesis, a su sucesiva segmentación en forma de proplaquetas, las cuales precisan de un último proceso de maduración y segmentación en la circulación pulmonar para convertirse en plaquetas funcionales (1) (2).
Ilustración 1: Hematopoyesis (3)
TROMBOPOYETINA Y SU RECEPTOR
Estructura y función
La trombopoyetina (TPO en adelante) es una hormona proteica y factor humoral capaz de estimular todas las etapas de la megacariocitopoyesis, incluyendo la proliferación, diferenciación, sobrevida,
endomitosis y maduración de los megacariocitos y liberación de plaquetas. Es sintetizada en forma constante en el hígado y en menor medida por los riñones y la médula ósea.
El receptor de trombopoyetina (TPO-R en adelante), también conocido como proteína de leucemia mieloproliferativa o CD110, es una proteína que en los humanos está codificada por el oncogén MPL (virus de la leucemia mieloproliferativa en ratones).
La TPO es una hormona glucoprotéica cuya estructura comprende (HIEGPTLRQ (2- Nal) LAARX10)2KNH2, en el que X10 se selecciona del grupo que consiste en sarcosina o ß-alanina, en el que 2-Nal es ß- (2-naftilo) alanina, al que se une covalentemente a un polímero hidrófilo.
El TPO-R está compuesto por un dominio transmembrana de 635 aminoácidos, con dos dominios de receptores de citocinas extracelulares y dos motivos de caja de receptores de citocinas intracelulares. Su papel en la formación de megacariocitos y plaquetas, como receptor de la TPO se demostró en ratones deficientes del mismo, los cuales fueron severamente trombocitopénicos.
Ilustración 2: Estructura química de la trombopoyetina
Mecanismo de acción de la TPO natural
La megacariocitopoyesis está regulada por diversas citoquinas y factores de crecimiento (4), incluidas la TPO, interleuquinas (IL-3, 6 y 11) y el stem cell factor (SCF), entre otras. Entre los reguladores negativos, se incluyen el transforming growth factor (TGF) β y el factor plaquetario 4.
Cuando la TPO se une a su receptor, genera la homodimerización del mismo, la activación de la tirosina quinasa JAK2 y diversas vías de señalización intracelular (MAPK, PI3K/Akt, la proteína adaptadora Shc y moléculas de la familia STAT).
La regulación molecular de la megacariotrombopoyesis involucra diversos factores de transcripción, entre los que se incluyen GATA-1, FLI-1, RUNX1, GFI1B, SRF/MAL y NF-E2.3
Ilustración 3: Unión al TPO-R y cascada de transducción de señales (5)
Regulación de los niveles de TPO
Anteriormente, se creía que la síntesis hepática de TPO era constitutiva y que la regulación de los niveles plasmáticos estaba controlada por su eliminación después de unirse al receptor Mpl. Según un modelo propuesto, llamado de "esponja", los niveles de TPO en plasma eran inversamente proporcionales a los receptores Mpl en megacariocitos y plaquetas (4). Con un aumento de plaquetas, la captación de TPO por el Mpl aumentaba, disminuyendo los niveles plasmáticos y reduciendo la megacariocitopoyesis. Al contrario, la disminución de plaquetas resultaba en niveles elevados de TPO en plasma y estimulaba la megacariocitopoyesis. Los niveles de TPO también dependían del número de megacariocitos, mostrando niveles elevados con la disminución de ambos (6). En condiciones inflamatorias, la síntesis hepática de TPO puede aumentar a través del estímulo de la citoquina proinflamatoria IL-6, que es liberada de los macrófagos y, a través de la estimulación con TNF-α de los fibroblastos, circula al hígado para mejorar la producción de TPO.
La trombocitopenia también conduce a una mayor producción de TPO por parte de las células del estroma de la médula ósea, aunque todavía no se comprende por completo el mediador/es moleculares implicados.
Ilustración 4: Trombopoyesis ante estímulos inflamatorios (6)
AGONISTAS DEL TPO-R
Romiplostim (NPLATE ®)
Morfología y funcionamiento
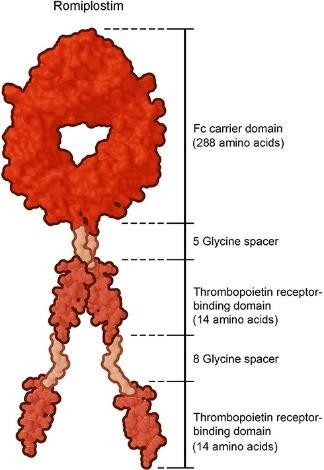
Es una molécula híbrida, que comprende cuatro dominios de unión con alta afinidad por el TPO-R y un dominio Fc transportador. Se produce mediante tecnología de ADN recombinante en Escherichia coli. No tiene homología de secuencia con TPO endógena. Romiplostim se une y activa el TPO-R en los precursores de megacariocitos en la médula ósea. Presenta afinidad similar que la TPO endógena, ya que es el único de los agonistas TPO-R capaz de unirse en el mismo sitio activo que la propia TPO, por lo que puede desplazar su unión al receptor (7).
Ilustración 5: Estructura química del Romiplostim (7)
Farmacocinética
Absorción: Tras la administración subcutánea de romiplostim, se obtuvieron las concentraciones séricas máximas tras 7-50 horas (mediana de 14 horas). Los niveles plasmáticos presentan una relación inversa con los recuentos plaquetarios (8).
Distribución: Presenta un descenso no lineal del volumen de distribución, que está en línea con la fijación mediada por células diana (megacariocitos y plaquetas) de romiplostim, que puede saturarse cuando se administran las dosis más altas. El volumen de distribución es relativamente bajo (122 mL/kg), lo que indica que se distribuye principalmente en el espacio extracelular y en menor medida a los tejidos (8).
Metabolismo: Como es una proteína de fusión recombinante, no se metaboliza a través de las vías hepáticas tradicionales (p. ej. citocromo P450). Se elimina principalmente por degradación proteolítica, que ocurre en los tejidos diana y en los sitios de eliminación celular (como los riñones y el hígado) (8).
Eliminación: La semivida de eliminación de romiplostim oscila entre 1 y 34 días (mediana, 3,5 días). La eliminación de romiplostim plasmático depende en parte del receptor de la TPO en las plaquetas. En consecuencia, para una dosis dada los pacientes con recuentos plaquetarios elevados se asocian a bajas concentraciones plasmáticas y viceversa (8).
Perfil de seguridad
Los efectos secundarios (9) notificados con mayor frecuencia en ≥ 5 % de los pacientes fueron artralgia (26 %), mialgia (14 %), dolor en las extremidades (13 %), dolor de hombro (8 %), mareos (17 %), parestesia (6 %), insomnio (16 %), dolor abdominal (11%) y dispepsia (7%).
Eltrombopag (REVOLADE ®)
Morfología y funcionamiento
Molécula no peptídica capaz de regular de la megacariocitopoyesis. Actúa como un ligando endógeno del TPO- R, ya que interacciona con el dominio transmembrana y activa sistemas de transducción de señales parecidos, pero no idénticos, a los de la TPO endógena, que inducen la proliferación y diferenciación de los megacariocitos y las células progenitoras de la médula ósea. No compite por el sitio de unión del receptor de TPO endógeno. Su unión puede inducir una mayor activación de la vía Akt respecto a la de JAK/STAT, induciendo así la proliferación megacariocítica en un mayor grado que la producción de plaquetas (9).
Farmacocinética
Absorción: Tras su administración oral se absorbe y alcanza un pico de concentración entre 2 y 6 horas. Si se proporciona junto con antiácidos y otros productos que contienen cationes polivalentes, como los derivados lácteos y los suplementos minerales, reduce significativamente su absorción, por lo que se recomienda tomarlo en ayunas (10).
Distribución: Tiene elevado grado de unión a proteínas plasmáticas humanas (> 99,9%). Eltrombopag es sustrato de BCRP (proteína actúa como una bomba de transporte activo para diversos sustratos) (10).
Metabolismo: Se metaboliza principalmente por hidrólisis, oxidación y conjugación con ácido glucurónico, glutatión o cisteína a través de las enzimas UGT1A1 y UGT1A3 en el hígado. También es sustrato de las enzimas del citocromo P450, (CYP1A2 y CYP2C8) (10).
Eliminación: El metabolito glucurónido se excreta principalmente por la bilis, mientras que el medicamento inalterado y sus metabolitos se eliminan tanto por la vía biliar (59%) como urinaria (31%). La vida media de eliminación plasmática es de aproximadamente 21 a 32 horas (10).
Perfil de seguridad
Se ha establecido la seguridad del tratamiento en pacientes con PTI de hasta 5,4 años en adultos y 7 años en niños. Las reacciones adversas más comunes notificadas en al menos el 3% de los pacientes fueron dolor de cabeza (10%), aumento de alanina aminotransferasa (5%), aumento del aspartato aminotransferasa (5%), cataratas (5%), fatiga (5%), aumento de bilirrubina en sangre (4%), náuseas (4%) y diarrea (3%) (9).
Ilustración 6: Diferencias de activación del TPO-R. Romiplostim y Eltrombopag
INDICACIONES TERAPÉUTICAS
Es causada por reacciones inmunitarias que aceleran la destrucción y reducen la producción de plaquetas. Los mecanismos comunes involucrados en la depuración plaquetaria incluyen mecanismos inmunes dependientes de autoanticuerpos antiplaquetarios y células T, apoptosis plaquetaria y modificaciones de glucanos.
La incidencia estimada de PTI en los Estados Unidos (EE. UU.) y Europa es de 3,3/1.000.000 en adultos por año y 6,4/100.000 en niños por año, mientras que la prevalencia estimada es de 9,5/100.000 en adultos y 5,3/100.000 en niños.
El tratamiento de primera línea para la PTI consiste en corticosteroides e inmunoglobulina intravenosa. En casos refractarios, se emplean agonistas del TPO- R (romiplostim, eltrombopag y avatrombopag), terapias citotóxicas, danazol y rituximab. En estos pacientes, los niveles de TPO endógenos más bajos (≤ 100 pg/ml) predicen una mayor probabilidad de respuesta a eltrombopag y romiplostim, en comparación con niveles de TPO más altos.
Los recuentos de plaquetas aumentaron de 1 a 3 días tras administración intravenosa y de 4 a 9 días tras administración subcutánea, alcanzando un máximo en los días 12 a 16.
Los modelos sugieren que la actividad de romiplostim está impulsada por la saturación de la ocupación del receptor en las plaquetas y los megacariocitos en lugar de la concentración sérica de romiplostim (9).
Trombocitopenia inducida por quimioterapia (TCI)
Los pacientes oncológicos a menudo padecen trombocitopenia por los efectos secundarios del tratamiento sobre la médula ósea. En los pacientes en los que este fenómeno se da de manera acusada, es frecuente que se reduzca la quimioterapia para reducir el riesgo de hemorragia o necesidad de transfusión con plaquetas, lo que puede repercutir negativamente en el tratamiento porque disminuye su efecto terapéutico y lo pospone en el tiempo (11).
La incidencia estimada de TCI es del 13% para tumores sólidos respecto al 28% para cánceres hematológicos. Se ha observado que el uso de estos fármacos corrige el recuento plaquetario y permite continuar con el tratamiento quimioterápico (12).
Se ha observado una relación entre infección por VHC y trombocitopenia inmunológica (PTI) y se estima que alrededor del 20% de los pacientes con PTI presentan serología positiva para el VHC.
La trombocitopenia asociada a la hepatitis C crónica (HCC) puede ser debida a diversas causas, entre ellas la disminución de la producción de TPO hepática, mielosupresión inducida por el VHC y el hiperesplenismo. El tratamiento anti-VHC basado en interferon-α-pegilado y ribavirina (pegIFNα + RBV), y la posible adición de un inhibidor de proteasa (telaprevir (TVR), boceprevir), ha demostrado efectos adversos hematológicos, entre ellos la trombocitopenia. El PegIFNα inhibe de manera directa la diferenciación de los megacariocitos hasta plaquetas mediada por TPO, bloqueando la cascada de fosforilación inducida por la activación del TPO-R, mientras que el mecanismo por el cual TVR produce trombocitopenia es desconocido. Según un estudio, tras el uso de eltrombopag en estos pacientes a dosis crecientes y la disminución del tratamiento de primera línea, se produce un aumento progresivo en el recuento plaquetario (13).
Ilustración 7: Ensayo clínico. Disminución de tratamiento anti-VHC
y aumento de eltrombopag (13)
La trombocitopenia es una complicación frecuente en pacientes con enfermedad hepática crónica (EHC). Se ha descrito que su prevalencia en la EHC es de hasta el 78% de los pacientes con cirrosis (14). Según un estudio, el uso de Avatrombopag (Ver características de eltrombopag), fue bien tolerado y obtuvo un resultado superior al grupo placebo para aumentar el recuento plaquetario, ya que menos pacientes requirieron una transfusión de plaquetas o un procedimiento de rescate por sangrado (15).
BIBLIOGRAFÍA
2.- Español I, Pujol-Moix N. Trombopoyetina: de su descubrimiento a sus perspectivas clínicas. Med Clínica. enero de 2000;114(13):511-6.
3.- Hematopoyesis. https://www.hemomadrid.com/fda-otorga-la-aprobacion-completa- ponatinib-leucemias-raras/hematopoyesis/
4.- Grozovsky R, Giannini S, Falet H, Hoffmeister KM. Regulating billions of blood platelets: glycans and beyond. Blood. 15 de octubre de 2015;126(16):1877-84.
5.- TPO-binds-the-distal-part-of-the-inactive-TPO-cMPL-receptor-and-creates-an- activated. https://www.researchgate.net/figure/TPO-binds-the-distal-part-of-the- inactive-TPO-cMPL-receptor-and-creates-an-activated_fig1_45509020
6.- Kaushansky K. The molecular mechanisms that control thrombopoiesis. J Clin Invest. 1 de diciembre de 2005;115(12):3339-47.
7.- Bussel JB, Soff G, Balduzzi A, Cooper N, Lawrence T, Semple JW. A Review of Romiplostim Mechanism of Action and Clinical Applicability. Drug Des Devel Ther. mayo de 2021;Volume 15:2243-68.
8.- AEMPS. Ficha técnica Romiplostim (NPLATE®). https://cima.aemps.es/cima/dochtml/ft/08497002/FT_08497002.html.
9.- Gilreath J, Lo M, Bubalo J. Thrombopoietin Receptor Agonists (TPO-RAs): Drug Class Considerations for Pharmacists. Drugs. julio de 2021;81(11):1285-305.
10.- AEMPS. Ficha técnica Eltrombopag (REVOLADE®). https://cima.aemps.es/cima/dochtml/ft/10612005/FichaTecnica_10612005.html
11.- Gao A, Zhang L, Zhong D. Chemotherapy-induced thrombocytopenia: literature review. Discov Oncol. 25 de enero de 2023;14(1):10.
12.- Soff GA, Miao Y, Bendheim G, Batista J, Mones JV, Parameswaran R, et al. Romiplostim Treatment of Chemotherapy-Induced Thrombocytopenia. J Clin Oncol. 1 de noviembre de 2019;37(31):2892-8.
13.- Beatriz Guglieri-Lopez, José Manuel Ventura-Cerdá, Jorge Carmena-Carmena, Mónica Climente-Martí. Eltrombopag for the treatment of thrombocytopenia in patients with chronic hepatitis C: two case reports. Farmacia Hospitalaria, Volume 37, Issue 5, 2013, Pages 417-419, ISSN 1130-6343,
https://doi.org/10.7399/fh.2013.37.5.733.
(https://www.sciencedirect.com/science/article/pii/S1130634323002891)
14.- Calleja-Panero JL, Esteban Mur R, Jarque I, Romero-Gómez M, Group SR, García Labrador L, et al. Chronic liver disease-associated severe thrombocytopenia in Spain: Results from a retrospective study using machine learning and natural language processing. Gastroenterol Hepatol. marzo de 2024;47(3):236-45.
15.- Terrault N, Chen YC, Izumi N, Kayali Z, Mitrut P, Tak WY, et al. Avatrombopag Before Procedures Reduces Need for Platelet Transfusion in Patients With Chronic Liver Disease and Thrombocytopenia. Gastroenterology. septiembre de 2018;155(3):705-18.





No hay comentarios:
Publicar un comentario
Se admiten comentarios que indiquen posibles errores en los textos y/o sugerencias de temas, y/o propuestas de mejoras en el blog y/o dudas sobre la realización de trabajos. Dado que este blog no es un consultorio médico, no se responderán preguntas realizadas con esa finalidad. Los comentarios que se consideren inapropiados, serán eliminados de inmediato, sin ningún tipo de excepción.