Autora : María Díaz Martínez
4º Curso de Medicina grupo "D" (Curso 2024/25)
Código de trabajo : 2423-MDM
INTRODUCCIÓN
Antes de abordar un tipo concreto de leucemia, debemos de saber que son las leucemias. Se define como un proceso caracterizado por la producción incontrolada de células hematopoyéticas anormales; habiltualmente estas son producidas en la médula ósea. Provoca que las células anormales se acumulen en distintas estructuras del organismo (1).
La leucemia se caracterizada por presentar gran heterogeneidad genética, que se relaciona con distintas alteraciones cromosómicas. Existen formas de leucemia crónica y de leucemia aguda. La leucemia mieloide crónica, es un síndrome mieloproliferativo de naturaleza clonal. A nivel genético, presenta traslocación del cromosoma (9;22) (q34; q11) que interviene en la formación del cromosoma Filadelfia (2).
Mientras que la leucemia linfoblástica aguda (LLA), es la neoplasia más frecuente en la infancia. Ocurre por una traslocación maligna de una célula progenitora linfoide inmadura con capacidad de expansión (3).
En este trabajo nos centraremos en la leucemia neutrofílica crónica (LNC), es un síndrome mieloproliferativo crónico verdaderamente raro en nuestras bibliografías y en los hospitales a día de hoy. Solo se han reportado unos 143 casos. Se caracteriza por una neutrofilia persistente en sangre periférica, así como una médula ósea hipercelular con hiperplasia de la serie granulocítica principalmente en fase madura (4).
EPIDEMIOLOGÍA
La leucemia neutrofílica crónica (LNC) es una enfermedad muy rara, descrita por primera vez en la literatura médica en 1920. No fue hasta 2001, cuando la OMS la reconoció como enfermedad diferenciada de otras (5).
Presenta una edad de inicio tardía, alrededor de los 65 años y afecta predominantemente al sexo masculino. No obstante, en 1996 se reportaron dos casos en jóvenes de 15 y 25 años. En ocasiones la fosfatasa alcalina y los niveles de vitamina B12 están aumentados lo que permite diferenciarla de una reacción leucemoide (4).
Puede darse en relación con otras neoplasias como el mieloma múltiple, síndrome mielodisplásico, policitemia vera o mielofibrosis primaria.
CITOGENÉTICA
La LNC se caracteriza por anomalías cromosómicas, como la trisomía 8 pero con cromosoma Filadelfia (Ph) y el gen de fusión bcr/abl negativo.
Tal mutación se manifiesta como una enfermedad caracterizada por neutrofilia persistente en sangre periférica, médula ósea hipercelular con hiperplasia en serie granulocítica, en su mayoría aumento de granulocitos maduros.
CLÍNICA
Al ser una enfermedad tan infrecuente, muchos pacientes se encuentran asintomáticos al inicio. Presentan clínica en relación con el aumento persistente de los niveles de neutrófilos y la progresión de la enfermedad, incluyendo (5) :
- Fatiga.
- Pérdida de peso.
- Hematomas que aparecen con facilidad.
- Dolores óseos.
- Síntomas B como sudores nocturnos.
- Hemorragias (hemorragia cerebral severa y epistaxis tras el diagnóstico de la enfermedad).
- Trastornos del tracto gastrointestinal y procesos inflamatorios sin infección.
Estos síntomas se podrían confundir con clínica general de un cuadro gripal o malestar general.
La peculiaridad que diferencia a la LNC (y también a la leucemia mieloide crónica) de las reacciones leucemoides son (6) :
- Hepatomegalia (75%).
- Esplenomegalia (100%) (produce en el paciente una sensación extraña en el costado izquierdo).
- Este cuadro clínico no se acompaña de episodios febriles.
ANALÍTICA Y ESTUDIO HEMATOLÓGICO
En sangre periférica se observa neutrofilia absoluta a expensas principalmente de elementos maduros, sin eosinofilia ni basofilia. Al diagnóstico los pacientes adultos suelen presentar un valor absoluto mayor a 7500 neutrófilos y bandas/mcL, que es es considerado como neutrofilia y leucocitosis >25x109/L. No suele haber anemia.
La médula ósea es hipercelular, con incremento del número y proporción de granulocitos neutrófilos, mieloblastos < 5% y patrón de maduración mieloide sin alteración (6).
Ilustración 1: AMO en paciente con leucemia neutrofílica crónica.
OTRAS CAUSAS DE NEUTROFILIA
La neutrofilia puede ser una respuesta fisiológica normal del organismo en respuesta a determinadas situaciones. A lo largo del día, de forma fisiológica los neutrófilos presentan fluctuaciones en función de los alimentos ingeridos, posición y determinados estímulos emocionales (6).
Se divide en neutrofilia primaria y secundaria:
- Neutrofilia primaria (alteración primeria funcional de la médula ósea):
- Enfermedad hereditaria que provoca neutrofilia.
- Neutrofilia crónica o de larga evolución que no llegamos a establecer la causa.
- Como consecuencia de leucemias agudas y crónicas.
- Alteraciones mieloproliferativas; quizá se podría relacionar también con algunos síndromes mielodisplásicos.
- Neutrofilia secundaria: se conoce a dichas situaciones en la que la función de la médula ósea es adecuada y la neutrofilia deriva de respuestas fisiologícas del organismo frente a determinadas circunstancias:
- Infecciones: endocarditis, neumonía, septicemia o leptospirosis.
- Procesos de gran estrés para el organismo como inflamatorios (Vasculitis, necrosis, infarto agudo de miocardio), quemaduras o traumatismos.
- Estrés físico o emocional.
- Tratamiento farmacológico como corticoides, sales de litio o beta agonistas entre otros.
- Intoxicación por plomo. Otras condiciones tóxicas: picaduras, metales pesados, vacunas, uremia o acidosis.
- Esplenectomía.
- Hemorragias, anemia hemolítica.
- Neoplasias no hematológicas: carcinoma de colon o carcinoma embrionario renal.
PRUEBAS COMPLEMENTARIAS
Dada la baja incidencia de la enfermedad, no se puede confirmar el diagnóstico de forma definitiva, pero se piden las siguientes pruebas para excluir otras patologías (5) :
Analítica (bioquímica, hemograma y coagulación): de las que destacan los siguientes hallazgos :
- Anemia leve (Hb < 11 g/dL).
- Valor de plaquetas normal o ligeramente disminuido (principalmente en fases avanzadas de la enfermedad y asociado a hepatomegalia y esplenomegalia).
- Elevación de la LDH (suele aumentar cuando el organismo requiere mayor producción de energía, por lo que en exceso puede indicar daño tisular o la presencia de determinados cánceres o enfermedades).
- Elevación de la vitamina B12.
- Aumento de los niveles de fosfatasa alcalina leucocítica (enzima presente en los glóbulos blancos, pueden aumentar en personar con procesos inflamatorios crónicos, determinados situaciones clínicas o procesos tumorales).
- Trisomía 8 (descubierta tras el análisis de 50 mitosis).
- Trisomía 9.
- Monosomía 2.
- Deleción 11(q23).
- Deleción del brazo largo del cromosoma 20.
- Deleción del cromosoma 7.
- Anormalidades (+9,20q-)(5)
- Trisomía 21.
- Traslocación (2,2)
Un hallazgo molecular de gran repercusión es la mutación del gen CSF3R: esencial para entender las bases moleculares de la leucemia neutrofílica crónica. Se encarga de activar el receptor del factor estimulante de colonias 3, implicado en la producción de neutrófilos. La mayoría de los pacientes con LNC, aproximadamente el 90%, presentan alguna mutación en dicho gen (8).
DIAGNÓSTICO
En la mayoría de las ocasiones los pacientes no presentan clínica característica de la enfermedad y se suele diagnosticar por exclusión (5).
Acuden a los servicios sanitarios con clínica general como fatiga o alteración motora. Al realizar pruebas complementarias en estos pacientes se observa hepatomegalia y/o esplenomegalia. En la realización de un aspirado de médula ósea también se suele observar hipercelularidad, esto nos hace sospechar en un síndrome mieloproliferativo de primeras o leucemia neutrofílica crónica, aunque en menos ocasiones porque es una clínica muy rara.
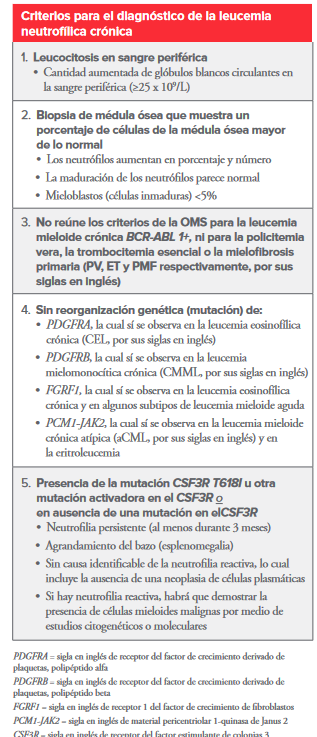
Se establecen unos criterios según la OMS para establecer una leucemia neutrofílica crónica.
Ilustración 2: Criterios diagnóstico de la OMS de LNC
(doble click en la imagen para ampliar)
DIAGNOSTICO DIFERENCIAL
Es importante realizar un exhaustivo diagnostico diferencial ya que se suele diagnosticar por exclusión.
Distintas situaciones que podemos plantearnos frente a estos pacientes (4).
- Leucocitosis por neutrofilia por causas tanto primerias como secundarias (ver apartado de fisiopatología).
- Reacción leucemoide: se diferencian en que esta situación no hay esplenomegalia, sino que el paciente presenta fiebre asociada a cuadro de sepsis. Así mismo presenta niveles menos elevados de vitamina B12 y ácido úrico.
- Leucemia mieloide crónica: marcada leucocitosis en sangre periférica con desviación hacia la izquierda y basofilia, a diferencia de los pacientes con LNC.
- Policitemia vera: se diferencian principalmente por la clínica hemática, en paciente con PV tenemos un hematocrito de 56% y hemoglobina mayor de 18 g/dL.
TRATAMIENTO
No existen protocolos de tratamiento concretos establecidos. Se habla de aplicar quimioterapia con hidroxiurea para controlar temporalmente la leucocitosis y la esplenomegalia (4).
Por otro lado, el interferón alfa muestra eficacia en determinados pacientes con respuestas duraderas al tratamiento.
Hasta la fecha no se reportan casos de curación completa de pacientes con leucemia neutrofílica crónica en fase acelerada o blástica con los tratamientos arriba citados, evolucionando a leucemia mieloide aguda.
El trasplante de médula ósea alogénico es el tratamiento más adecuado para erradicar la enfermedad.
Nuevos fármacos como el Ruxolitinib, es un inhibidor de JAK 1 y 2, actualmente se usa para el tratamiento de la mielofibrosis y policitemia vera con intolerancia al tratamiento con hidroxiurea. Se encuentra en fase de investigación su uso en la LNC, ya que en pacientes con mutaciones en el gen CSF3R, podría tener resultados positivos (5).
BIBLIOGRAFIA
1.- García SG. Técnicas de citogenética para el estudio de las leucemias. Artículo en revisión. junio de 2022;38(2):15.
2.- Pavón Morán V, Hernández Ramírez P, Martínez Antuña G, Agramonte Llanes O, Jaime Fagundo JC, Bravo Regueiro J. Leucemia mieloide crónica: Actualización en Citogenética y Biología Molecular. Revista Cubana de Hematología, Inmunología y Hemoterapia. agosto de 2005;21(2):0-0.
3.- López AGM, Frías VL, López MH, García IC, Alonso PIN, Atienza AL. Temas de Formación Continuada. Pediatría integral. 2016;20(6):97.
4.- Quintero MV. Leucemia neutrofílica crónica con tetrasomía 8. Revista Colombiana de Cancerología. 2004;8(2):40-4.
5.- Leukemia C Lymphoma society. Información sobre la leucemia neutrofílica crónica. 2017;(30-S):7.
6.- Dra. Wendy Cabrera Aguilar*. Leucemia neutrofílica crónica: reporte de caso. UMSA. 2012;10(1):33-7.